题目内容
18.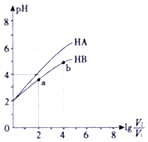 在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )
在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )| A. | a、b两点水的电离程度a小于b | |
| B. | HA、HB两种酸溶液pH相同时,c(HA)<c(HB) | |
| C. | 曲线上a、b两点$\frac{c({B}^{-})}{c(HB)•(O{H}^{-})}$一定相等 | |
| D. | 25℃时,NaA溶液中c(A-)一定大于NaB溶液中c(B-) |
分析 在25℃下,稀释HA、HB两种酸溶液PH=2,加水稀释lg$\frac{{V}_{2}}{{V}_{1}}$=2,稀释100倍,HA溶液PH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸,
A.ab两点稀释倍数不同,b点氢离子浓度小,水电离程度大;
B.HA为强酸,HB为弱酸分析;
C.$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$=$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{Kw}$;
D.HA为强酸,HB为弱酸,25℃时,NaA溶液的pH=7,NaB溶液PH>7.
解答 解:A.ab两点稀释倍数不同,b点氢离子浓度小水抑制程度小,水电离程度大,a、b两点水的电离程度a小于b,故A正确;
B.HA为强酸,HB为弱酸存在电离平衡,pH相同时,c(HA)<c(HB),故B正确;
C.$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$=$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{Kw}$,温度不变比值一定不变,故C正确;
D.HA为强酸,HB为弱酸,25℃时,NaA是强碱强碱盐溶液的pH=7,NaB溶液中B-离子水解溶液显碱性PH>7,溶液中溶质浓度不知,NaA溶液中c(A-)不一定大于NaB溶液中c(B-),故D错误;
故选D.
点评 本题考查了弱电解质电离平衡、溶液PH变化的分析判断、电离平衡常数和离子积常数的含义、盐类水解等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.下列化学药品的保存方法合理的是( )
| A. | 金属钾保存在乙醇中 | |
| B. | 常温下浓硫酸可存放在铁质容器中 | |
| C. | NaOH溶液保存在玻璃塞的试剂瓶中 | |
| D. | FeCl3溶液中加入少量还原铁粉存放 |
9.下列属于非电解质的是( )
| A. | 干冰 | B. | 液氯 | C. | 氯化钠固体 | D. | 水 |
6.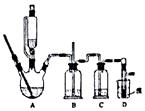 实验室制备1,2-溴乙烷的反应原理如下:
实验室制备1,2-溴乙烷的反应原理如下:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如表:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)装置B的作用是安全瓶的作用.
(3)在装置c中应加入c(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应己经结束的最简单方法是溴的颜色完全褪去.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(6)若产物中有少量未反应的Br2,最好用b(填正确选项前的字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(8)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备1,2-溴乙烷的反应原理如下:
实验室制备1,2-溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度(g/cm3) | 0.79 | 2.2 | 0.71 |
| 沸点(℃) | 78.5 | 132 | 34.6 |
| 熔点(℃) | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)装置B的作用是安全瓶的作用.
(3)在装置c中应加入c(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应己经结束的最简单方法是溴的颜色完全褪去.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(6)若产物中有少量未反应的Br2,最好用b(填正确选项前的字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(8)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,23g NO2含有NA 个氧原子 | |
| B. | 1 L 0.1 mol/L NaHSO3溶液中含有的HSO3-数目为0.1 NA | |
| C. | 1 L pH=1 的硫酸溶液中含有的H+ 数为0.2 NA | |
| D. | 标准状况下,2.24 L CO 和CO2混合气体中含有的氧原子数为0.15NA |
10.有3.92g铁的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到7.0g固体沉淀物,这种铁的氧化物为( )
| A. | Fe3O4 | B. | FeO | C. | Fe2O3 | D. | Fe5O7 |
20.化学与生产、生活、社会密切相关.下列有关说法正确的是( )
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表明的铜锈 | |
| C. | 服用阿司匹林出现水杨酸反应时,用NaOH溶液解毒 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强 |
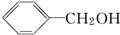 ,B
,B .
. .
.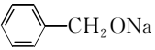 +H2↑.
+H2↑.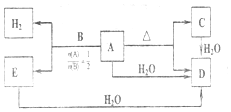
 .
.