题目内容
13.欲用98%的浓硫酸(ρ=1.84g/mL)配制浓度为0.5mol•L-1的稀硫酸500ml.(1)选用的主要仪器有:量筒,烧杯,玻璃棒,试剂瓶,还缺少仪器的名称是胶头滴管,500mL的容量瓶;
(2)请将下列各操作,按正确的操作顺序序号填在横线上ADECB;
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至环形刻度线 D.稀释浓H2SO4
E.将溶液冷却至室温后转入容量瓶
(3)简要回答下列问题:
①所需浓硫酸的体积为13.6mL;
②如果实验室有15mL、20mL、50mL规格的量筒,应选用15mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度偏低(“偏高”、“偏低”、“无影响”).
分析 (1)依据配置步骤选择合适的仪器;
(2)依据步骤计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签解答;
(3)依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据稀释前后溶液含溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适的量筒,依据C=$\frac{n}{V}$分析错误操作对溶液物质的量浓度的影响.
解答 解:(1)配制稀硫酸的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,需要使用的仪器有量筒,烧杯,玻璃棒,胶头滴管,500ml容量瓶;
故答案为:胶头滴管,500ml容量瓶;
(2)配制稀硫酸的步骤为:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签,所以正确的顺序为:ADECB,
故答案为:ADECB;
(3)c=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L,稀释前后溶液含溶质的物质的量不变,设需要浓硫酸体积为V,则V×18.4mol/L=0.5mol/L×500mL,
解得:V=13.6ml,所以需要浓硫酸13.6ml,应选择15ml的量筒;量取时发现量筒不干净,用水洗净后直接量取浓硫酸,相当于稀释浓硫酸,量取的硫酸溶液中含硫酸的物质的量偏小,溶液的浓度偏低;
故答案为:①13.6;②15;偏低.
点评 本题考查了配制一定物质的量浓度的溶液的方法,难度中等,侧重对学生能力的培养和解题方法的指导和训练,熟悉配置原理和过程是解题关键,注意物质的量浓度与质量百分数浓度之间的换算.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
3.下列关于铜及其化合物的说法中正确的是( )
| A. | 在铜的精炼中,粗铜为阳极 | |
| B. | 铜在空气中也容易生锈,可用稀硝酸洗涤 | |
| C. | 铜离子氧化性较强,能氧化I-,所以Cu2+与S2-反应将生成硫单质 | |
| D. | 铜金属性比铁弱,因此Cu2+与铁反应生成Fe3+ |
4.检验溶液中是否含有某种离子,下列操作方法及结论正确的是( )
| A. | 加入硝酸银溶液有白色沉淀生成,证明含有氯离子 | |
| B. | 加入氯化钡溶液有白色沉淀生成,继续加过量的稀盐酸,沉淀不消失,证明溶液中含有硫酸根离子 | |
| C. | 加浓氢氧化钠溶液后加热,产生使湿润红色石蕊试纸变蓝的气体,证明含有铵根离子 | |
| D. | 加入盐酸,放出能使澄清石灰水变浑浊的无色无味气体,证明含有碳酸根离子 |
1.从氯元素的价态判断,下列物质中氯元素不能表现氧化性的是( )
| A. | NaCl | B. | Cl2 | C. | HClO | D. | KClO3 |
8.有下列五种溶液:①NaOH ②MgSO4③Ba(NO3)2④Cu(NO3)2⑤KCl.不用其它试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的正确顺序是( )
| A. | ④①②③⑤ | B. | ④③①②⑤ | C. | ⑤④③②① | D. | ②③①④⑤ |
18.如图所示,装置中都盛有0.1mol/L 的NaCl 溶液,放置一定时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是( )
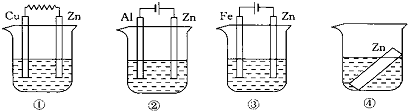

| A. | ①②③④ | B. | ②①③④ | C. | ③①④② | D. | ②①④③ |
5.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
2.现欲分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图.字母代表所加物质,数字代表操作方法.下列说法中错误的是( )
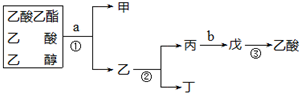

| A. | 甲是乙酸乙酯 | |
| B. | ①、②操作都是蒸馏 | |
| C. | a试剂是饱和Na2CO3溶液 | |
| D. | 制备乙酸乙酯时加试剂的顺序是:乙醇、浓硫酸、乙酸 |
3.在密闭容器中一定量混合气体发生反应:2A(g)+2B(g)?xC(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大到原来2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是( )
| A. | x=4 | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的体积分数增大 |