题目内容
1.从氯元素的价态判断,下列物质中氯元素不能表现氧化性的是( )| A. | NaCl | B. | Cl2 | C. | HClO | D. | KClO3 |
分析 处于元素最低价时只具有还原剂,而处于中间价或最高价时可具有氧化性,以此来解答.
解答 解:A.NaCl中Cl元素的化合价为-1价,为最低价,只具有还原性,故A选;
B.Cl元素的化合价为0,为中间价,具有氧化性,故B不选;
C.Cl元素的化合价为+1价,为中间价,具有氧化性,故C不选;
D.Cl元素的化合价为+5价,为中间价,具有氧化性,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握元素的化合价与微粒性质的关系为解答的关键,侧重分析与应用能力的考查,注意结合化合价分析,题目难度不大.

练习册系列答案
相关题目
9.下列物质依次按照混合物、氧化物、电解质和非电解质的顺序排列的一组是( )
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水银、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
6.下列离子方程式书写正确的是( )
| A. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2 H+═CO2↑+H2O | |
| C. | 硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
10.下列应用与盐类的水解无关的是( )
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
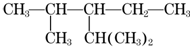 ,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种.
,该有机物系统命名是2,4-二甲基-3-乙基戊烷,1mol该烃完全燃烧需消耗氧气14mol,该烃一氯取代物有7种.