题目内容
4.检验溶液中是否含有某种离子,下列操作方法及结论正确的是( )| A. | 加入硝酸银溶液有白色沉淀生成,证明含有氯离子 | |
| B. | 加入氯化钡溶液有白色沉淀生成,继续加过量的稀盐酸,沉淀不消失,证明溶液中含有硫酸根离子 | |
| C. | 加浓氢氧化钠溶液后加热,产生使湿润红色石蕊试纸变蓝的气体,证明含有铵根离子 | |
| D. | 加入盐酸,放出能使澄清石灰水变浑浊的无色无味气体,证明含有碳酸根离子 |
分析 A、根据加入硝酸银生成的可能是AgCl沉淀,也可能是别的白色沉淀判断;
B、根据向某溶液中加入硝酸酸化的氯化钡溶液,可能生成AgCl、BaSO4等沉淀判断;
C、根据氢氧化钠和铵盐反应生成氨气,氨气和水反应生成氨水,氨水是一种碱能使湿润的红色石蕊试纸变蓝分析判断;
D、碳酸根、碳酸氢根等离子都可以和氢离子之间反应产生气体.
解答 解:A、加入硝酸银生成的可能是AgCl沉淀,也可能是别的白色沉淀如硫酸银,故A不正确;
B、向某溶液中加入硝酸酸化的氯化钡溶液,可能生成AgCl、BaSO4等沉淀,不能证明溶液中含有硫酸根离子,故B不正确;
C、向某溶液中加入氢氧化钠,产生能使湿润的红色石蕊试纸变蓝的气体即为氨气,则证明该溶液含有铵根离子,故C正确;
D、加入盐酸,放出能使澄清石灰水变浑浊的无色无味气体,证明含有碳酸根离子或是碳酸氢根离子中的至少一种,故D不正确.
故选C.
点评 本题考查离子鉴别题目,做题时注意从题目中找出反应的典型现象,根据物质的性质进行推断.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
14.胶体区别于其它分散系的本质特征是( )
| A. | 胶体能发生电泳现象 | B. | 胶体能产生丁达尔现象 | ||
| C. | 胶体粒子直径在1~100nm之间 | D. | 胶体在一定条件下能聚沉 |
15.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
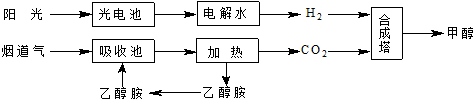
(1)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,图示合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-.
(2)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-131.9kJ/mol.
(3)500℃时,密闭容器中充入1mol/L CO2和3mol/LH2发生反应:
CO2(g)+3H2(g)$?_{高温高压}^{催化剂}$CH3OH(g)+H2O(g)
测得有关数据如表:
计算该反应的平衡常数K(保留一位小数)5.3;
(4)以渗透于多孔基质的惰性导电物材料为电极,用35~50%KOH为电解液,甲醇和空气为原料,构成碱性燃料电池.请写电极反应
正极:O2+4e-+2H2O=4OH-,负极:2CH3OH-12e-+16OH-=2CO32-+12H2O.
(5)合成甲醇的另一种反应是:CO(g)+2H2(g)?CH3OH(g),试分析此反应是放热(填“放热”或“吸热”)反应.对已达平衡此反应在保证氢气浓度不变的情况下,增大容器的体积,平衡B移动;
A.正向移动 B.不移动 C.逆向移动 D.不一定.

(1)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,图示合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-.
(2)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-131.9kJ/mol.
(3)500℃时,密闭容器中充入1mol/L CO2和3mol/LH2发生反应:
CO2(g)+3H2(g)$?_{高温高压}^{催化剂}$CH3OH(g)+H2O(g)
测得有关数据如表:
| 反应时间/min | 3 | 5 | 7 | 10 | 13 |
| c(CO2)/mol•L-1 | 0.50 | 0.37 | 0.30 | 0.25 | 0.25 |
(4)以渗透于多孔基质的惰性导电物材料为电极,用35~50%KOH为电解液,甲醇和空气为原料,构成碱性燃料电池.请写电极反应
正极:O2+4e-+2H2O=4OH-,负极:2CH3OH-12e-+16OH-=2CO32-+12H2O.
(5)合成甲醇的另一种反应是:CO(g)+2H2(g)?CH3OH(g),试分析此反应是放热(填“放热”或“吸热”)反应.对已达平衡此反应在保证氢气浓度不变的情况下,增大容器的体积,平衡B移动;
A.正向移动 B.不移动 C.逆向移动 D.不一定.
19.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 澄清的石灰水与稀盐酸反应 Ca (OH)2+2H+═Ca2++2H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
9.下列物质依次按照混合物、氧化物、电解质和非电解质的顺序排列的一组是( )
| A. | 淀粉溶液、CuO、HClO、Cu | |
| B. | 普通玻璃、H2O、FeCl3、葡萄糖 | |
| C. | 水银、Na2O、BaSO4、SO3 | |
| D. | KAl(SO4)2•12H2O、KClO3、NH3•H2O、CH3CH2OH |
14.两种烃以任意比例混合,在105℃时1L混合烃与9L O2混合,充分燃烧后恢复至原状态,所得气体体积仍为10L.下列各组混合烃中符合此条件的是( )
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H6 | D. | C2H2、C3H6 |