题目内容
5.下列关于F、Cl、Br、I性质的比较,不正确的是( )| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
分析 A.卤素单质的颜色从上到下逐渐加深;
B.卤素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比;
C.元素的非金属性越强,其简单阴离子的还原性越弱;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故A正确;
B.卤素单质都是分子晶体,分子晶体熔沸点与其相对分子质量成正比,随着原子序数增大其单质的相对分子质量增大,所以其单质的熔沸点随着原子序数增大而增大,故B正确;
C.元素的非金属性越强,其简单阴离子的还原性越弱,其非金属性随着原子序数增大而减弱,所以简单阴离子的还原性随着原子序数增大而增强,则被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,随着原子序数增大其非金属性减弱,所以其氢化物的稳定性随着原子序数增大而减弱,故D错误;
故选D.
点评 本题考查同一主族元素结构性质递变规律,为高频考点,明确结构与性质关系是解本题关键,知道非金属性强弱判断方法,题目难度不大.

练习册系列答案
相关题目
15.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如图所示,试回答下列问题:
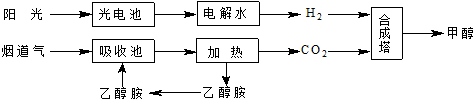
(1)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,图示合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-.
(2)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-131.9kJ/mol.
(3)500℃时,密闭容器中充入1mol/L CO2和3mol/LH2发生反应:
CO2(g)+3H2(g)$?_{高温高压}^{催化剂}$CH3OH(g)+H2O(g)
测得有关数据如表:
计算该反应的平衡常数K(保留一位小数)5.3;
(4)以渗透于多孔基质的惰性导电物材料为电极,用35~50%KOH为电解液,甲醇和空气为原料,构成碱性燃料电池.请写电极反应
正极:O2+4e-+2H2O=4OH-,负极:2CH3OH-12e-+16OH-=2CO32-+12H2O.
(5)合成甲醇的另一种反应是:CO(g)+2H2(g)?CH3OH(g),试分析此反应是放热(填“放热”或“吸热”)反应.对已达平衡此反应在保证氢气浓度不变的情况下,增大容器的体积,平衡B移动;
A.正向移动 B.不移动 C.逆向移动 D.不一定.

(1)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,图示合成线路中用作CO2吸收剂.用离子方程式表示乙醇胺水溶液呈弱碱性的原因HOCH2CH2NH2+H2O?HOCH2CH2NH3++OH-.
(2)CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-131.9kJ/mol.
(3)500℃时,密闭容器中充入1mol/L CO2和3mol/LH2发生反应:
CO2(g)+3H2(g)$?_{高温高压}^{催化剂}$CH3OH(g)+H2O(g)
测得有关数据如表:
| 反应时间/min | 3 | 5 | 7 | 10 | 13 |
| c(CO2)/mol•L-1 | 0.50 | 0.37 | 0.30 | 0.25 | 0.25 |
(4)以渗透于多孔基质的惰性导电物材料为电极,用35~50%KOH为电解液,甲醇和空气为原料,构成碱性燃料电池.请写电极反应
正极:O2+4e-+2H2O=4OH-,负极:2CH3OH-12e-+16OH-=2CO32-+12H2O.
(5)合成甲醇的另一种反应是:CO(g)+2H2(g)?CH3OH(g),试分析此反应是放热(填“放热”或“吸热”)反应.对已达平衡此反应在保证氢气浓度不变的情况下,增大容器的体积,平衡B移动;
A.正向移动 B.不移动 C.逆向移动 D.不一定.
10.下列应用与盐类的水解无关的是( )
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
14.两种烃以任意比例混合,在105℃时1L混合烃与9L O2混合,充分燃烧后恢复至原状态,所得气体体积仍为10L.下列各组混合烃中符合此条件的是( )
| A. | CH4、C2H4 | B. | CH4、C3H6 | C. | C2H4、C3H6 | D. | C2H2、C3H6 |

