题目内容
下列现象或事实可用同一原理解释的是( )
| A、氯水和二氧化硫使品红溶液褪色 |
| B、亚硫酸钠和水玻璃长期暴露在空气中变质 |
| C、稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 |
| D、浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
考点:氯气的化学性质,硝酸的化学性质,二氧化硫的化学性质
专题:元素及其化合物
分析:A.次氯酸漂白性是因为次氯酸具有强氧化性,二氧化硫漂白,是因为可以和有色物质化合生成无色物质;
B.亚硫酸根具有强的还原性,容易被氧化成硫酸根,硅酸钠能够与空气中的二氧化碳反应;
C.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子;
D.浓盐酸易挥发,浓硫酸具有吸水性.
B.亚硫酸根具有强的还原性,容易被氧化成硫酸根,硅酸钠能够与空气中的二氧化碳反应;
C.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子;
D.浓盐酸易挥发,浓硫酸具有吸水性.
解答:
解:A.氯水使品红溶液褪色是因为有色物质被氧化成无色物质,二氧化硫使品红溶液褪色是因为与有色物质发生化合反应生成无色物质,二者原理不同,故A错误;
B.亚硫酸钠被空气中的氧气氧化而变质,水玻璃长期暴露在空气中变质是因为与二氧化碳反应,二者原因不同,故B错误;
C.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子生成单质碘,故C正确;
D.浓盐酸和浓硫酸长期暴露在空气中浓度变小,原因不同,浓盐酸是因为氯化氢挥发,溶质的物质的量减少,浓硫酸是因为具有吸水性,溶剂增多,故D错误;
故选C.
B.亚硫酸钠被空气中的氧气氧化而变质,水玻璃长期暴露在空气中变质是因为与二氧化碳反应,二者原因不同,故B错误;
C.稀硝酸和三氯化铁都具有强的氧化性,能够氧化碘离子生成单质碘,故C正确;
D.浓盐酸和浓硫酸长期暴露在空气中浓度变小,原因不同,浓盐酸是因为氯化氢挥发,溶质的物质的量减少,浓硫酸是因为具有吸水性,溶剂增多,故D错误;
故选C.
点评:本题考查了常见无机物质的性质,题目难度不大,熟悉各种物质的性质是解题的关键,注意A选项为易错选项.

练习册系列答案
相关题目
NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、由D和18O所组成的水11g,所含的中子数为4NA |
| B、常温常压下,8g O2含有4NA个电子 |
| C、25℃时,pH=13的1L Ba(OH)2溶液中含有OH-的数目为0.2 |
| D、1L 1mol/L的NaAlO2水溶液中含有的氧原子数为2NA |
用图所示装置进行实验,不能达到实验目的是( )
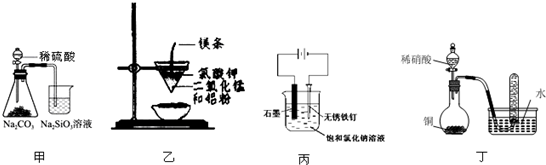

| A、用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B、用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C、用丙装置可实现对铁钉的保护 |
| D、用丁装置验证铜与稀硝酸反应的气体产物只有NO |
m g铜与足量浓H2SO4共热时完全反应,在标准状况下生成n L气体,则被还原的H2SO4的量是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )


| A、①是其他条件一定时,反应速率随温度变化的图象,正反应△H<0 |
| B、②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
| C、③是在有无催化剂存在下建立的平衡过程图象,a是使用催化剂时的曲线 |
| D、④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
下列物质中属于共价化合物是( )
| A、Cl2 |
| B、NaOH |
| C、NH4Cl |
| D、HI |
下列各族离子在指定溶液中一定能大量共存的是( )
| A、由水电离出的c(OH-)=10-13mol?L-1的溶液中:Na+、Ba2+、Cl-、Br- | ||
B、
| ||
| C、含大量Al3+的溶液中:K+、Na+、ClO-、SO42- | ||
| D、无色溶液中:K+、Na+、SO42-、MnO4- |
链状有机物X分子中含有m个-CH3,n个-CH2-,a个 ,其余为-Cl,则X分子中-Cl的数目可能是( )
,其余为-Cl,则X分子中-Cl的数目可能是( )
 ,其余为-Cl,则X分子中-Cl的数目可能是( )
,其余为-Cl,则X分子中-Cl的数目可能是( )| A、a+2-m |
| B、2n+3a-m |
| C、n+m+a |
| D、a+2n+2-m |