题目内容
链状有机物X分子中含有m个-CH3,n个-CH2-,a个 ,其余为-Cl,则X分子中-Cl的数目可能是( )
,其余为-Cl,则X分子中-Cl的数目可能是( )
 ,其余为-Cl,则X分子中-Cl的数目可能是( )
,其余为-Cl,则X分子中-Cl的数目可能是( )| A、a+2-m |
| B、2n+3a-m |
| C、n+m+a |
| D、a+2n+2-m |
考点:有机化合物中碳的成键特征
专题:有机物分子组成通式的应用规律
分析:有机物主要靠C原子连接,每个碳原子都必须形成4个共价键,以1条碳链分析考虑,先分析若只连接甲基,计算连接的甲基数目,再根据分子中含有的甲基数目计算-Cl数,1个-CH-可连接1个甲基,-CH2-不管多少个只能连接两个-CH3,据此计算判断.
解答:
解:若只连接甲基,-CH2-不管多少个只能连接两个-CH3,a个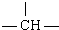 能连接a个-CH3,所以n个-CH2-,a个
能连接a个-CH3,所以n个-CH2-,a个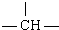 连接-CH3共计a+2个.由于分子中含有m个-CH3,所以连接的-Cl为a+2-m.
连接-CH3共计a+2个.由于分子中含有m个-CH3,所以连接的-Cl为a+2-m.
故选A.
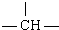 能连接a个-CH3,所以n个-CH2-,a个
能连接a个-CH3,所以n个-CH2-,a个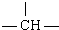 连接-CH3共计a+2个.由于分子中含有m个-CH3,所以连接的-Cl为a+2-m.
连接-CH3共计a+2个.由于分子中含有m个-CH3,所以连接的-Cl为a+2-m.故选A.
点评:本题考查有机化合物中成键特征,难度中等,关键清楚有机物主要靠C原子连接,每个碳原子都必须形成4个共价键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列现象或事实可用同一原理解释的是( )
| A、氯水和二氧化硫使品红溶液褪色 |
| B、亚硫酸钠和水玻璃长期暴露在空气中变质 |
| C、稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 |
| D、浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
下列关于元素周期表的叙述不正确的是( )
| A、元素周期表中共有7个周期16个族 |
| B、过渡元素都是金属元素 |
| C、主族元素原子的最外层电子数与其族序数相同 |
| D、所含元素种类最多的族为第Ⅷ族 |
下列说法符合绿色化学思想的是( )
| A、对工业生产硝酸产生的废气、废水进行严格处理 |
| B、利用根瘤菌固氮以减少氮肥生产厂 |
| C、实验室制备NO2时在通风橱内进行 |
| D、建设“花园式工厂” |
下列说法正确的是( )
| A、Na2O、Al2O3均属于碱性氧化物 |
| B、有发光、发热、变色、生成气体或沉淀、爆炸等现象的不一定发生了化学变化 |
| C、在水溶液中有H+电离出来的化合物一定属于酸 |
| D、CaCl2固体、NaOH固体、液氨、纯盐酸四种物质都属于化合物 |
下列关于碱金属按Li、Na、K、Rb、Cs的顺序叙述中不正确的是( )
| A、最外层都只有1个电子,在化学反应中容易失去1个电子表现出强还原性 |
| B、单质的熔点和沸点依次降低 |
| C、单质都能与水反应生成碱,都能在空气中燃烧生成过氧化物 |
| D、原子半径逐渐增大,单质与水反应的剧烈程度逐渐增强 |
某短周期元素X,其原子的电子层数为n,最外层电子数为(2n+1).下列有关X的说法中不正确的是( )
| A、X能与某些金属元素形成化合物 |
| B、X形成的单质可能与水发生氧化还原反应 |
| C、X不可能为第一周期元素 |
| D、由X形成的含氧酸均为强酸 |
A和B是短周期元素,A2-和B+的核外电子总数之差为8,下列说法中正确的是( )
| A、A和B的原子序数之差为8 |
| B、A和B原子最外层电子数之和为8 |
| C、A和B原子最外层电子数之和为3 |
| D、A、B原子核外电子数总和可能为11 |