题目内容
(1) 、 、 为天然有机高分子化合物.
(2)三大合成材料 、 、 .
(3)把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g);2min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol?(L?min)-1.试计算:前2min内用X的浓度变化表示的平均反应速率为 ;2min末时Y的浓度为 ;化学方程式中n的值是 .
(4)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量.其热化学方程式为 .
(5)已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
(2)三大合成材料
(3)把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g);2min末已生成0.3mol W,若测知以Z的浓度变化表示的反应速率为0.05mol?(L?min)-1.试计算:前2min内用X的浓度变化表示的平均反应速率为
(4)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量.其热化学方程式为
(5)已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为
考点:有机高分子化合物的结构和性质,热化学方程式,反应速率的定量表示方法
专题:基本概念与基本理论
分析:(1)相对分子质量在10000以上的有机化合物为高分子化合物,高分子化合物分为天然高分子化合物、合成高分子化合物;
(2)合成材料主要有塑料、合成橡胶、合成纤维;
(3)先根据W的物质的量求出X的物质的量的变化量,根据v=
计算v(X);计算出2min内Y的浓度变化量,2min末时Y的浓度为Y的起始浓度减去2min内Y的浓度变化量;利用速率之比等于化学计量数之比计算n的值;
(4)根据热化学方程式的书写方法;
(5)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
(2)合成材料主要有塑料、合成橡胶、合成纤维;
(3)先根据W的物质的量求出X的物质的量的变化量,根据v=
| △n |
| △t |
(4)根据热化学方程式的书写方法;
(5)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答:
解:(1)淀粉、纤维素、蛋白质、天然橡胶等属于天然有机高分子化合物,故答案为:淀粉;纤维素;蛋白质;或天然橡胶;
(2)三大合成材料是指:塑料、合成纤维、合成橡胶,故答案为:塑料;合成纤维; 合成橡胶;
(3)物质的量之比等于化学计量数之比,所以△n(X)=
△n(W)=
×0.3mol=0.2mol,
2min内用X的浓度变化表示的平均反应速率v(X)=
=
=0.05 mol?(L?min)-1,
答:前2min内用X的浓度变化表示的平均反应速率为0.05 mol?(L?min)-1;
(2)物质的量之比等于化学计量数之比,所以△n(Y)=
△n(W)=
×0.3mol=0.25mol,
所以2min内Y的浓度变化量△c(Y)=
=
=0.125mol/L,
Y的起始浓度为
=0.3mol/L,
所以2min末时Y的浓度为0.3mol/L-0.125mol/L=0.175mol/L,
速率之比等于化学计量数之比,所以0.05 mol?(L?min)-1:0.05 mol?(L?min)-1=4:n,解得,n=4.
故答案为:0.05mol/(L.min);0.175mol/L;4;
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有10NA个电子转移时,放出1300kJ的热量,
则热化学方程式为:C2H2(g)+
O2(g)→2CO2(g)+H2O(l)△H=-1300kJ?mol-1,
故答案为:C2H2(g)+5/2 O2(g)=2 CO2(g)+H2O((l)△H=-1300 kJ/mol;
(5)在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
所以热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ?mol-1,故答案为:N2(g)+3H2(g)≒2NH3(g)△H=-92 kJ/mol.
(2)三大合成材料是指:塑料、合成纤维、合成橡胶,故答案为:塑料;合成纤维; 合成橡胶;
(3)物质的量之比等于化学计量数之比,所以△n(X)=
| 2 |
| 3 |
| 2 |
| 3 |
2min内用X的浓度变化表示的平均反应速率v(X)=
| △c(X) |
| △t |
| ||
| 2min |
答:前2min内用X的浓度变化表示的平均反应速率为0.05 mol?(L?min)-1;
(2)物质的量之比等于化学计量数之比,所以△n(Y)=
| 5 |
| 6 |
| 5 |
| 6 |
所以2min内Y的浓度变化量△c(Y)=
| △n(Y) |
| V |
| 0.25mol |
| 2L |
Y的起始浓度为
| 0.6mol |
| 2L |
所以2min末时Y的浓度为0.3mol/L-0.125mol/L=0.175mol/L,
速率之比等于化学计量数之比,所以0.05 mol?(L?min)-1:0.05 mol?(L?min)-1=4:n,解得,n=4.
故答案为:0.05mol/(L.min);0.175mol/L;4;
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量,所以有10NA个电子转移时,放出1300kJ的热量,
则热化学方程式为:C2H2(g)+
| 5 |
| 2 |
故答案为:C2H2(g)+5/2 O2(g)=2 CO2(g)+H2O((l)△H=-1300 kJ/mol;
(5)在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
所以热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ?mol-1,故答案为:N2(g)+3H2(g)≒2NH3(g)△H=-92 kJ/mol.
点评:本题考查化学反应速率的计算、热化学方程式的书写,难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
相关题目
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、0.5 mol Al与足量盐酸反应转移电子数为1.5NA |
| B、标准状况下,11.2 L SO3所含的分子数为0.5NA |
| C、0.5 mol CH4所含的电子数为2.5NA |
| D、46 g NO2和N2O4的混合物含有的分子数为1NA |
化学在生产和生活中有着重要的应用.下列叙述中,正确的是( )
| A、从海水中提取物质都必须通过化学反应才能实现 |
| B、可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、煤经过气化和液化等物理变化可以转化为清洁燃料 |
下列反应的离子方程式正确的是( )
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2-+2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2=Fe3++2H2O |
| D、淀粉碘化钾溶液在空气中变蓝4I-+O2+2H2O=2I2+4OH- |


 (R为烃基),则有机物A的结构
(R为烃基),则有机物A的结构 ,试写出苧烯的同分异构体(用
,试写出苧烯的同分异构体(用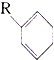 表示)与
表示)与 反应的化学方程式:
反应的化学方程式:
 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示: