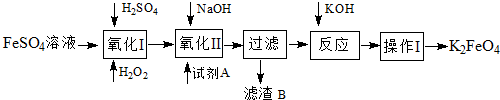
题目内容
10. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)═2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:C3H8 +26OH--20e-=3CO32-+17H2O;
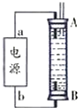
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | CO2 |
| H2O | CO | ||||
| 1 | 650 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 2 | 0.4 | 0.4 | 3 |
| 3 | 900 | 2 | 0.4 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
分析 (1)①根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
②根据氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,据此写出反应的化学方程式即可;
(2)①根据C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,而负极电极反应式=总反应方程式-正极的电极反应式来解答;
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;
B、电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
C、阳极应该用铁电极,阴极用惰性电极亦可;
D、B电极反应是阴极氢离子放电生成氢气;
(3)①比较第二组的第一组反应物的转化率大小以及温度对化学平衡和转化率的影响来判断;
②首先利用三段式计算出平衡时各物质的浓度,根据K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$计算;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动;
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,反应的化学方程式为:PdCl2+CO+H2O=Pd↓+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd↓+CO2+2HCl;
(2)①C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,负极发生氧化反应,电极反应式为:C3H8 +26OH--20e-=3CO32-+17H2O,
故答案为:C3H8 +26OH--20e-=3CO32-+17H2O;
②A、因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故选:ABD;
(3)①实验1中CO的转化率为$\frac{1.6mol}{4mol}$×100%=40%,实验2中CO的转化率为$\frac{0.4mol}{2mol}$×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故答案为:放;
②H2O(g)+CO(g)?CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
转化 0.4mol/L 0.4mol/l 0.4mol/l 0.4mol/l
平衡 0.6mol/L 1.6mol/L 0.4mol/l 0.4mol/l
根据K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=$\frac{1}{6}$,
故答案为:$\frac{1}{6}$;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动,应是使用了催化剂,又由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,
故答案为:使用了催化剂或增大了压强.
点评 本题考查热化学方程式、电极反应的书写以及化学平衡的计算、离子浓度大小比较,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,题目难度中等.

(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
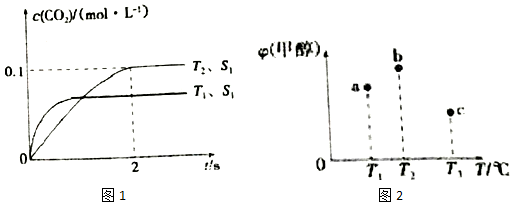
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
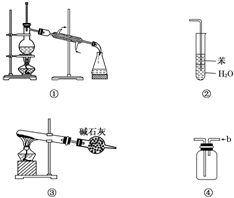
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收氨气,能够防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于制备少量CO2 | |
| D. | 装置④a口进气可收集Cl2、NO2等气体 |
| A. | ②④⑥ | B. | ①③④ | C. | ①③⑤⑥ | D. | ②⑤ |
(1)写出F原子的外围电子排布式3d64s2.
| 元 素 | M | F | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)F和M(质子数为25)两元素的部分电离能数据列于右表:比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是:Mn2+的3d轨道电子排布为半满状态较稳定.
(4)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
(5)如图a、b分别为M、F晶体的堆积模型,假设M的原子半径分别为Ranm,它的空间利用率:(不用化简)M$\frac{π}{3\sqrt{2}}$.

| A. | Fe2O3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al |
| A. | Cl2 | B. | O2 | C. | 溴水 | D. | KMnO4酸性溶液 |