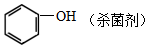题目内容
7.用结构简式写出正己烷的同分异构CH3CH2CH2CH2CH2CH3;(CH3)2CHCH2CH2CH3;CH3CH2CH(CH3)CH2CH3;(CH3)2CHCH(CH3)2;(CH3)3CCH2CH3 .分析 根据主链减碳作为取代基进行书写己烷的异构体,以此解答该题.
解答 解:主链为6个碳原子时:CH3CH2CH2CH2CH2CH3;
主链为5个碳原子时:(CH3)2CHCH2CH2CH3、CH3CH2CH(CH3)CH2CH3;
主链为4个碳原子时:(CH3)2CHCH(CH3)2、(CH3)3CCH2CH3 ;
故答案为:CH3CH2CH2CH2CH2CH3;(CH3)2CHCH2CH2CH3;CH3CH2CH(CH3)CH2CH3;(CH3)2CHCH(CH3)2;(CH3)3CCH2CH3 .
点评 本题考查同分异构体的判断,为高频考点,侧重于学生的分析能力的考查,注意把握同分异构体的判断方法,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
4.既可以用来鉴别乙烯和乙烷,又可以用来除去乙烷中混有的少里乙烯的最佳方法是( )
| A. | 混合气体通过盛有水的洗气瓶 | |
| B. | 通过装有过量浓溴水的洗气瓶 | |
| C. | 先将混合气体通过酸性高锰酸钾溶液中,然后再通入NaOH溶液中 | |
| D. | 混合气与过量氢气混合 |
5.常温下,某溶液中可以发生反应:X+2Y3+═2Y2+X2+,则①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性大于X2+的氧化性要强.上述叙述中正确的是( )
| A. | ②④⑥ | B. | ①③④ | C. | ①③⑤⑥ | D. | ②⑤ |
2.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F原子的外围电子排布式3d64s2.
(2)与A22-互为等电子体的单质是N2,A22-中成键原子的杂化类型是sp
(3)F和M(质子数为25)两元素的部分电离能数据列于右表:比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是:Mn2+的3d轨道电子排布为半满状态较稳定.
(4)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因:H2O2分子间存在氢键,与水分子可形成氢键;
(5)如图a、b分别为M、F晶体的堆积模型,假设M的原子半径分别为Ranm,它的空间利用率:(不用化简)M$\frac{π}{3\sqrt{2}}$.
(1)写出F原子的外围电子排布式3d64s2.
| 元 素 | M | F | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)F和M(质子数为25)两元素的部分电离能数据列于右表:比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是:Mn2+的3d轨道电子排布为半满状态较稳定.
(4)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
(5)如图a、b分别为M、F晶体的堆积模型,假设M的原子半径分别为Ranm,它的空间利用率:(不用化简)M$\frac{π}{3\sqrt{2}}$.

12.下列有关化学用语使用正确的是( )
| A. | S2-的结构示意图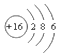 | B. | NH3结构式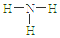 | C. | CO2的电子式: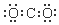 | D. | HCl电子式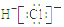 |
19.既能跟硫酸反应又能跟NaOH溶液反应的化合物是( )
| A. | Fe2O3 | B. | NaHCO3 | C. | Na2CO3 | D. | Al |
16.进行化学实验时应强化安全和环保意识,下列做法正确的是( )
| A. | 制取氯气时为防止中毒应在露天的环境中进行 | |
| B. | 用试管加热碳酸氢钠固体时使试管口略向上倾斜 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 金属钠着火时应使用沙土盖灭 |
 ⑥
⑥