题目内容
1.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
分析 设浓氨水的体积为V,稀释前后溶液中溶质的质量不变,氨水的密度小于水的密度,浓度越大密度越小,稀释后得到氨水的密度变大,据此解答.
解答 解:设浓氨水的体积为V,密度为ρ(浓),稀释后密度为ρ(稀),稀释前后溶液中溶质的质量不变,则:稀释后质量分数ω=$\frac{ρ(浓)×V×25%}{2Vρ(稀)}$,氨水的密度小于水的密度,浓度越大密度越小,所以ρ(浓)<ρ(稀),所以$\frac{ρ(浓)×V×25%}{2Vρ(稀)}$<12.5%,
故选C.
点评 本题考查了溶液稀释后质量分数计算,明确氨水密度小于水、稀释前后溶质的质量不变是解题关键,题目难度中等

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
9.下列除杂方法中正确的一组是( )
| A. | 溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可加NaOH溶液,振荡、静置、分液 |
10.大多数有机物都能燃烧,目前人类活动所需要的能源中,化石燃料占有相当比重,请回答下列问题:
(1)某烃充分燃烧后,产生CO2和H2O的物质的量之比为2:3,则该烃的实验式为CH3.
(2)在100℃、1.01×105Pa下,1L乙炔和丙烷的混合气体与8LO2混合,经充分燃烧后,恢复到起始温度和压强,所得气体总体积为9L,则原混合气体中乙炔和丙烷体积比为1:1.
(3)已知下列几种物质的燃烧热:
相同质量的上述四种物质,在标况下充分燃烧后,放出热量最多的是C2H6(写化学式).
(1)某烃充分燃烧后,产生CO2和H2O的物质的量之比为2:3,则该烃的实验式为CH3.
(2)在100℃、1.01×105Pa下,1L乙炔和丙烷的混合气体与8LO2混合,经充分燃烧后,恢复到起始温度和压强,所得气体总体积为9L,则原混合气体中乙炔和丙烷体积比为1:1.
(3)已知下列几种物质的燃烧热:
| 物质 | C | CO | C2H6 | C2H5OH |
| 燃烧热/KJ•mol-1 | 393.5 | 283 | 1559.8 | 1366.8 |
9.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO 2、N 2O 4)的混合物共0.9mol,这些气体恰好能被500mL 2.0mol/L NaOH溶液完全吸收,溶液中生成NaNO 3和NaNO 2,则原混合气体中NO的物质的量为( )
| A. | 0.3mol | B. | 0.4mol | C. | 0.5mol | D. | 0.6mol |
16.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
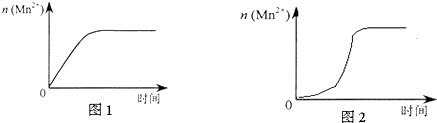
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
10.纳米碳是“纳米材料”中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的分散系①是浊液 ②是胶体 ③静置后析出黑色碳粒 ④能产生丁达尔效应.判断正确的是( )
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | ①③④ |
11.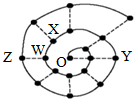 某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
 某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点(最中心的点)代表起点元素.下列说法中正确的是( )| A. | 物质YO可能具有较强的氧化性 | |
| B. | 图中离O点越远的元素,其原子半径一定越大 | |
| C. | O2X、WO3分子内都含有氢键,所以沸点都较高 | |
| D. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的Z元素 |
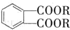 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示: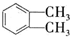 $→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]
$→_{①光照}^{Cl_{2}}$[A]$\stackrel{②}{→}$[B]$→_{③△}^{Cu、O_{2}}$[C]$\stackrel{④}{→}$[D]$→_{⑤ROH/△}^{浓硫酸}$[DMP]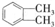 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.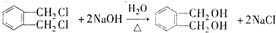 .
. .
. 制备DMP的另一种途径:
制备DMP的另一种途径: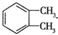 $→_{O_{2}①}^{催化剂、△}$
$→_{O_{2}①}^{催化剂、△}$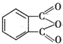 $→_{F②}^{适当条件}$[DMP]
$→_{F②}^{适当条件}$[DMP]