题目内容
13.10mL某气态烃在80mL O2中充分燃烧,得到液态水和体积为65mL的混合气体(气体体积均在相同条件下测定),该气态烃不可能是( )| A. | 丙烷 | B. | 乙烷 | C. | 丙烯 | D. | 甲烷 |
分析 令烃的分子式为CxHy,烃充分燃烧:CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(l),利用体积差量计算判断.
解答 解:依题意,氧气的体积过量,设气态烃的分子式为CxHy,完全燃烧的通式为CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(l),该反应中气体体积之比等于系数之比,则1mL气态烃和(x+$\frac{y}{4}$)mL氧气变为xmL二氧化碳气体时,理论上气体体积减少了(1+$\frac{y}{4}$)mL,实际上10mL气态烃与过量氧气反应后,气体体积减少了(10+80-65)mL,因此$\frac{1}{1+\frac{y}{4}}=\frac{10}{10+80-65}$,解得:y=6,说明该气态烃中氢原子数为6,碳原子数小于等于4,由于丙烷、乙烷、丙烯、甲烷的分子式分别为C3H8、C2H6、C3H6、CH4,则丙烷和甲烷都不可能,乙烷和丙烯都可能,故BC选项均错误,
故选AD.
点评 本题考查烃燃烧通式的应用,涉及烃的分子通式、烃分子完全燃烧的通式、系数之比等于气体的体积之比、烃分子中氢原子数、气态烃分子中的碳原子数等,比较容易.

练习册系列答案
相关题目
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA | |
| B. | 制取标准状况下22.4 L Cl2,需转移的电子数为2NA | |
| C. | 2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA | |
| D. | 标准状况下3.36 L HF里含有的原子总数为0.3NA |
4.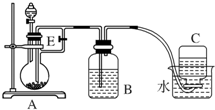 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
 如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )
如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化.实验提供的试剂:铁屑、6mol/L硫酸溶液、NaOH溶液.下列说法错误的是( )| A. | B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑 | |
| B. | 实验开始时应先将活塞E关闭 | |
| C. | 生成Fe(OH)2的操作为:关闭E,使A中溶液压入B瓶中 | |
| D. | 取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
1.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
8.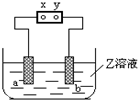 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
 图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )
图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的( )| a极板 | b极析 | X电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 负极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
| A. | A | B. | B | C. | D |
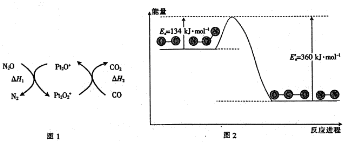
18.N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其反应为N2O(g)+CO(g) CO2(g)+N2(g)△H,有关化学反应的物质变化过程(图1)及能量变化过程(图2)如下:
下列说法正确的是( )

下列说法正确的是( )
| A. | 由图1可知:△H1=△H+△H2 | |
| B. | 由图2可知△H=-226 kJ/mol | |
| C. | 为了实现转化需不断向反应器中补充Pt2O+和Pt2O2+ | |
| D. | 由图2可知该反应正反应的活化能大于逆反应的活化能 |
2.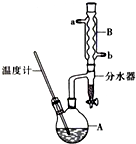 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
反应物和产物的相关数据如下
合成正丁醚的步骤:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为:正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的主要实验装置如图:反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11g.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中.
写出步骤②中制备正丁醚的化学方程式2CH3CH2CH2CH2OH
 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O.(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(4)步骤④中最后一次水洗的目的为洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(5)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃b. 117℃c. 135℃d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为:正丁醇,下层液体的主要成分为水.(填物质名称)
(7)本实验中,正丁醚的产率为33.85%.
3.现有MgCl2、AlCl3、CuCl2、FeCl3、FeCl2、NH4Cl六种溶液,如果只用一种试剂把它们区分开来,这种试剂是( )
| A. | 氨水 | B. | AgNO3 | C. | NaOH | D. | BaCl2 |