题目内容
9.下列除杂方法中正确的一组是( )| A. | 溴苯中混有溴,加入氢氧化钠溶液,振荡、静置、分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可加NaOH溶液,振荡、静置、分液 |
分析 A.溴与NaOH溶液反应后,与溴苯分层;
B.溴、苯酚、三溴苯酚均易溶于苯;
C.乙烯被高锰酸钾氧化生成二氧化碳;
D.二者均与NaOH反应.
解答 解:A.溴与NaOH溶液反应后,与溴苯分层,则入氢氧化钠溶液,振荡、静置、分液可分离,故A正确;
B.溴、苯酚、三溴苯酚均易溶于苯,不能除杂,应加NaOH溶液、分液,故B错误;
C.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,应选溴水、洗气,故C错误;
D.二者均与NaOH反应,不能除杂,应选饱和碳酸钠溶液、分液,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及除杂原则,题目难度不大.

练习册系列答案
相关题目
4.下列变化中不属于化学变化的是( )
| A. | 紫色的石蕊试液中通入CO2后变色 | B. | SO2漂白草编制品 | ||
| C. | 木炭使红棕色的NO2气体褪色 | D. | 淀粉遇碘变蓝色 |
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6 g 铁粉与足量水蒸气反应,失去的电子数为0.3NA | |
| B. | 制取标准状况下22.4 L Cl2,需转移的电子数为2NA | |
| C. | 2.3 g Na在空气中完全燃烧,失去的电子数为0.1NA | |
| D. | 标准状况下3.36 L HF里含有的原子总数为0.3NA |
1.质量百分含量为25%的氨水用等体积的水稀释后,所得溶液的溶质质量分数( )
| A. | 等于12.5% | B. | 大于12.5% | C. | 小于12.5% | D. | 无法确定 |
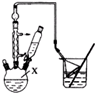 对叔丁基苯酚
对叔丁基苯酚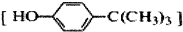 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.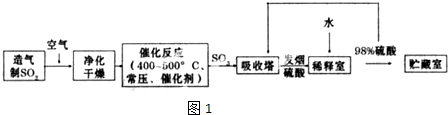
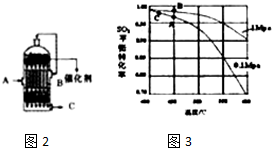
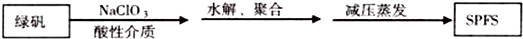
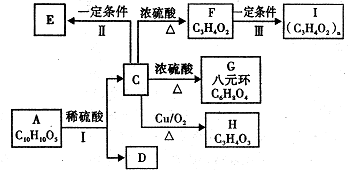
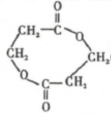 ,反应Ⅲ的化学方程式为
,反应Ⅲ的化学方程式为 .
.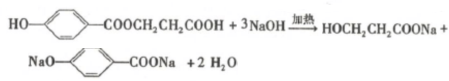 .
.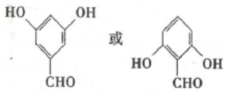 .
.