题目内容
常温下,有物质的量浓度、体积都相同的NaA(pH=8)溶液和NaB(pH=12)溶液,下列说法中不正确的是( )
| A、NaA溶液中c(Na+)-c(A-)=10-6mol?L-1 |
| B、NaB溶液中c(H+)+c(HB)=10-2mol?L-1 |
| C、将两溶液混合,混合溶液中:c(OH-)>5×10-3mol?L-1 |
| D、两溶液中的离子总数不相等 |
考点:酸碱混合时的定性判断及有关ph的计算,离子浓度大小的比较
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.根据NaA溶液中的电荷守恒可得:c(Na+)-c(A-)=c(OH-)-c(H+);
B.NaB溶液中存在质子守恒:c(H+)+c(HB)=c(OH-);
C.NaB溶液的pH=12,氢氧根离子浓度为0.01mol/L,不考虑NaA溶液中氢氧根离子,则混合液中c(OH-)=5×10-3mol?L-1,所以混合液中c(OH-)>5×10-3mol?L-1;
D.根据两溶液中的电荷守恒进行判断.
B.NaB溶液中存在质子守恒:c(H+)+c(HB)=c(OH-);
C.NaB溶液的pH=12,氢氧根离子浓度为0.01mol/L,不考虑NaA溶液中氢氧根离子,则混合液中c(OH-)=5×10-3mol?L-1,所以混合液中c(OH-)>5×10-3mol?L-1;
D.根据两溶液中的电荷守恒进行判断.
解答:
解:A.pH=8的NaA中氢氧根离子浓度为:10-6mol?L-1,则氢离子浓度为:10-8mol?L-1,根据电荷守恒可得:c(Na+)-c(A-)=c(OH-)-c(H+)=10-6mol?L-1-10-8mol?L-1=9.9×10-7mol?L-1,故A错误;
B.pH=12的NaB溶液中,氢氧根离子浓度为:10-2mol?L-1,根据质子守恒可得:c(H+)+c(HB)=10-2mol?L-1,故B正确;
C.NaB溶液的pH=12,溶液中氢氧根离子浓度为10-2mol?L-1,若不考虑NaA溶液中氢氧根离子,则混合液中c(OH-)=5×10-3mol?L-1,溶液中还存在A-水解生成的氢氧根离子,所以混合液中c(OH-)>5×10-3mol?L-1,故C正确;
D.NaA溶液中:c(Na+)+c(H+)=c(A-)+c(OH-),NaB溶液中:c(Na+)+c(H+)=c(B-)+c(OH-),两溶液中总浓度分别为:2c(Na+)+2c(H+)NaA、
2c(Na+)+2c(H+)NaB,两溶液中c(Na+)相等,溶液的pH不相等,则氢离子浓度一定不相等,则两溶液中离子总数不相等,故D正确;
故选A.
B.pH=12的NaB溶液中,氢氧根离子浓度为:10-2mol?L-1,根据质子守恒可得:c(H+)+c(HB)=10-2mol?L-1,故B正确;
C.NaB溶液的pH=12,溶液中氢氧根离子浓度为10-2mol?L-1,若不考虑NaA溶液中氢氧根离子,则混合液中c(OH-)=5×10-3mol?L-1,溶液中还存在A-水解生成的氢氧根离子,所以混合液中c(OH-)>5×10-3mol?L-1,故C正确;
D.NaA溶液中:c(Na+)+c(H+)=c(A-)+c(OH-),NaB溶液中:c(Na+)+c(H+)=c(B-)+c(OH-),两溶液中总浓度分别为:2c(Na+)+2c(H+)NaA、
2c(Na+)+2c(H+)NaB,两溶液中c(Na+)相等,溶液的pH不相等,则氢离子浓度一定不相等,则两溶液中离子总数不相等,故D正确;
故选A.
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,侧重考查盐的水解原理、溶液酸碱性与溶液pH的关系,注意电荷守恒、物料守恒的含义及应用方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列说法正确的是( )
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C、1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |
设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A、88.0g 干冰中含有的电子数为8.0NA |
| B、常温下,11.2 L 乙烯在氧气中完全燃烧转移的电子数为6.0NA |
| C、常温下1.0 L 0.1 mol?L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA |
| D、1.2g 金刚石中含有的碳碳键数为0.4 NA |
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g 样品,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol?L-1 盐酸进行滴定,得到如下曲线.以下说法或操作正确的是( )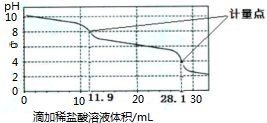

| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
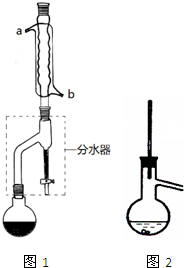 乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:
乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为: