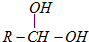题目内容
 乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:
乙酸正丁酯常用作织物、人造革和塑料生产过程中的溶剂,石油和医药工业中的萃取剂,也用于香料复配以及香蕉、菠萝、杏、梨等多种香味剂的成分.实验室制备乙酸正丁酯的化学方程式为:CH3COOH+CH3CH2CH20H
| 浓H2SO4 |
| △ |
制备过程中还可能有的副反应有
2CH3CH2CH2OH
| 浓H2SO4 |
| △ |
主要实验步骤如下:
Ⅰ合成:
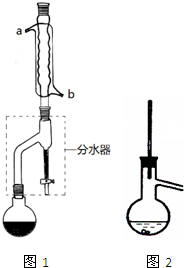
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离与提纯:
①将烧瓶中反应后的混后物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/g?mL-1 | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
(1)如图整个装置可看作由分水器、圆底烧瓶和
(2)如何判断该合成反应达到了终点:
(3)在操作步骤①时,用右手压住分液漏斗的玻璃塞,左手握住
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在
A.水 B.甘油(沸点290℃) C.砂子 D.石蜡油(沸点200~300℃)
如果蒸馏装置如图2所示,则收集到的产品中可能混有
(5)反应结束后,若放出的水为6.98mL(水的密度为1g?mL-1),则正丁醇的转化率约为
考点:制备实验方案的设计
专题:实验设计题
分析:(1)由装置图可知,装置由分水器、圆底烧瓶和冷凝管组成;冷凝水应该从下口进上口出;
(2)加热反应时会有少量正丁醇挥发进入分水器,分水器的液面会升高;
(3)振荡分液漏斗时,右手压住分液漏斗的玻璃塞,左手握住旋塞,用力振荡;在操作步骤②后(即酯层用无水硫酸镁干燥后),应先把固液混合物分离,再转入蒸馏烧瓶;
(4)乙酸正丁酯的沸点为126.1℃,选择沸点稍高的液体加热;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,则乙酸正丁酯的杂质为正丁醚;
(5)反应结束后,若放出的水为6.98mL(水的密度为1g?mL-1),即6.98g,根据方程式计算消耗的正丁醇的质量,再求出转化率.
(2)加热反应时会有少量正丁醇挥发进入分水器,分水器的液面会升高;
(3)振荡分液漏斗时,右手压住分液漏斗的玻璃塞,左手握住旋塞,用力振荡;在操作步骤②后(即酯层用无水硫酸镁干燥后),应先把固液混合物分离,再转入蒸馏烧瓶;
(4)乙酸正丁酯的沸点为126.1℃,选择沸点稍高的液体加热;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,则乙酸正丁酯的杂质为正丁醚;
(5)反应结束后,若放出的水为6.98mL(水的密度为1g?mL-1),即6.98g,根据方程式计算消耗的正丁醇的质量,再求出转化率.
解答:
解:(1)由装置图可知,装置由分水器、圆底烧瓶和冷凝管组成;冷凝管中的冷凝水应该从下口进上口出,所以从b管口通入;
故答案为:冷凝管;b;
(2)加热反应时会有少量正丁醇挥发进入分水器,分水器的液面会升高,当反应完全时,不再有正丁醇挥发进入分水器,则分水器中的液面不再升高,则合成反应达到了终点;
故答案为:分水器中水面不再升高;
(3)振荡分液漏斗时,右手压住分液漏斗的玻璃塞,左手握住旋塞,用力振荡;在操作步骤②后(即酯层用无水硫酸镁干燥后),应先把固液混合物分离,即通过过滤分离出乙酸丁酯,再把乙酸丁酯再转入蒸馏烧瓶;
故答案为:旋塞;过滤;
(4)乙酸正丁酯的沸点为126.1℃,选择沸点稍高的液体加热,所以可以在甘油和石蜡油中加热,水的沸点为100℃,加热温度太低,用砂子加热温度太高不易控制;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,正丁醚与乙酸丁酯互溶,水洗和10%碳酸钠溶液洗时不能除去,所以蒸馏时会有少量挥发进入乙酸丁酯,则乙酸正丁酯的杂质为正丁醚;
故答案为:BD;正丁醚;
(5)反应结束后,若放出的水为6.98mL(水的密度为1g?mL-1),则反应生成的水为6.98mL-5.00mL=1.98mL,即1.98g,设参加反应的正丁醇为xg,
CH3COOH+CH3CH2CH20H
CH3COOHCH2CH2CH3+H2O
74 18
xg 1.98g
则x=
=8.14g,
则正丁醇的转化率约为
×100%=88%;
故答案为:88%.
故答案为:冷凝管;b;
(2)加热反应时会有少量正丁醇挥发进入分水器,分水器的液面会升高,当反应完全时,不再有正丁醇挥发进入分水器,则分水器中的液面不再升高,则合成反应达到了终点;
故答案为:分水器中水面不再升高;
(3)振荡分液漏斗时,右手压住分液漏斗的玻璃塞,左手握住旋塞,用力振荡;在操作步骤②后(即酯层用无水硫酸镁干燥后),应先把固液混合物分离,即通过过滤分离出乙酸丁酯,再把乙酸丁酯再转入蒸馏烧瓶;
故答案为:旋塞;过滤;
(4)乙酸正丁酯的沸点为126.1℃,选择沸点稍高的液体加热,所以可以在甘油和石蜡油中加热,水的沸点为100℃,加热温度太低,用砂子加热温度太高不易控制;正丁醇和乙酸易溶于水,在用水洗、10%碳酸钠溶液洗时,已经被除去,正丁醚与乙酸丁酯互溶,水洗和10%碳酸钠溶液洗时不能除去,所以蒸馏时会有少量挥发进入乙酸丁酯,则乙酸正丁酯的杂质为正丁醚;
故答案为:BD;正丁醚;
(5)反应结束后,若放出的水为6.98mL(水的密度为1g?mL-1),则反应生成的水为6.98mL-5.00mL=1.98mL,即1.98g,设参加反应的正丁醇为xg,
CH3COOH+CH3CH2CH20H
| 浓H2SO4 |
| △ |
74 18
xg 1.98g
则x=
| 74×1.98g |
| 18 |
则正丁醇的转化率约为
| 8.14g |
| 9.3g |
故答案为:88%.
点评:本题考查了物质的制备实验方案设计,题目涉及实验操作、实验原理、物质的性质的应用、分离提纯、有关方程式的计算等,题目难度中等,侧重于考查学生的实验探究能力和数据处理能力.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
常温下,有物质的量浓度、体积都相同的NaA(pH=8)溶液和NaB(pH=12)溶液,下列说法中不正确的是( )
| A、NaA溶液中c(Na+)-c(A-)=10-6mol?L-1 |
| B、NaB溶液中c(H+)+c(HB)=10-2mol?L-1 |
| C、将两溶液混合,混合溶液中:c(OH-)>5×10-3mol?L-1 |
| D、两溶液中的离子总数不相等 |
下列实验装置设计不能达到目的是( )
A、 装置气密性的检查 |
B、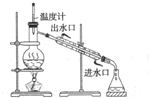 碘的CCl4溶液中分离I2,并回收CCl4 |
C、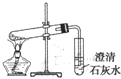 探究NaHCO3 |
D、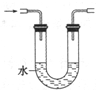 氨气的吸收 |
关于下列各实验或装置的叙述中,正确的是( )


| A、实验①可用于制取氨气 |
| B、实验②中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点 |
| C、装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸 |
| D、装置④可用于从酒精水溶液中制取无水乙醇 |
下列叙述不正确的是( )
| A、油脂是多种高级脂肪酸的甘油酯,要合理摄入 |
| B、乙酸乙酯和高级脂肪酸甘油酯都能与氢氧化钠溶液发生反应,都有酸性 |
| C、植物油能使酸性高锰酸钾溶液褪色 |
| D、油脂的水解反应是取代反应 |
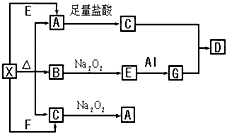 如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1mol.X、E、G的焰色反应均为黄色.回答下列问题:
如图表示的反应关系中,部分产物被略去.已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A、无色液体B、无色气体C各1mol.X、E、G的焰色反应均为黄色.回答下列问题: 已知当一个碳原子上连有两个羟基时,易发生下列转化:
已知当一个碳原子上连有两个羟基时,易发生下列转化: