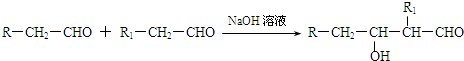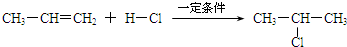题目内容
亚硝酸(HNO2)在工业上用于有机合成.温度为0℃时,Ka(HNO2)=7.0×10-4,.回答下列问题:
(1)HNO2是 电解质(天“强”或“弱”),写出HNO2的电离方程式: .
(2)亚硝酸可用亚硝酸盐或氮的氧化物为原料制备.
①将均接近0℃的Ba(NO2)2溶液与稀硫酸混合可制备HNO2.Ba(NO2)2中N的化合价为 ;从Ba(NO2)2溶液与稀硫酸反应后的混合物中分离出HNO2溶液的方法是 .
②将二氧化氮和氮的另外一种氧化物混合溶液在接近0℃的水中,可制备亚硝酸溶液,且反应中氧化剂与还原剂的物质的量之比为1:1,则另外一种氮的氧化物的分子式为 .
(3)常温下HNO2不稳定,容易发生分解反应生成硝酸和一种氮的氧化物,且该反应中氧化产物和还原产物的物质的量之比为1:2,HNO2分解的化学方程式为 .
(1)HNO2是
(2)亚硝酸可用亚硝酸盐或氮的氧化物为原料制备.
①将均接近0℃的Ba(NO2)2溶液与稀硫酸混合可制备HNO2.Ba(NO2)2中N的化合价为
②将二氧化氮和氮的另外一种氧化物混合溶液在接近0℃的水中,可制备亚硝酸溶液,且反应中氧化剂与还原剂的物质的量之比为1:1,则另外一种氮的氧化物的分子式为
(3)常温下HNO2不稳定,容易发生分解反应生成硝酸和一种氮的氧化物,且该反应中氧化产物和还原产物的物质的量之比为1:2,HNO2分解的化学方程式为
考点:电解质与非电解质,化学方程式的有关计算,氧化还原反应的计算,物质的分离、提纯和除杂
专题:
分析:(1)亚硝酸溶液中存在电离平衡,所以亚硝酸是弱酸,亚硝酸电离生成氢离子和亚硝酸根离子;
(2)①根据亚硝酸中氮的化合价为+3价;由强酸制弱酸的原理可知Ba(NO2)2溶液与稀硫酸反应得到硫酸钡沉淀和后HNO2溶液,可用过滤的方法除去硫酸钡沉淀;
②由题意结合氧化还原化合价升价相等可知,氮的另外一种氧化物为一氧化氮;
(3)由题意结合氧化还原化合价升价相等可知,氮的氧化物为一氧化氮.
(2)①根据亚硝酸中氮的化合价为+3价;由强酸制弱酸的原理可知Ba(NO2)2溶液与稀硫酸反应得到硫酸钡沉淀和后HNO2溶液,可用过滤的方法除去硫酸钡沉淀;
②由题意结合氧化还原化合价升价相等可知,氮的另外一种氧化物为一氧化氮;
(3)由题意结合氧化还原化合价升价相等可知,氮的氧化物为一氧化氮.
解答:
解:(1)亚硝酸溶液中存在电离平衡,所以亚硝酸是弱酸,亚硝酸电离生成氢离子和亚硝酸根离子,所以电离方程式为HNO2?H++NO2-,故答案为:弱;HNO2?H++NO2-;
(2)①亚硝酸中氮的化合价为+3价,所以Ba(NO2)2中N的化合价为+3价;
由强酸制弱酸的原理可知Ba(NO2)2溶液与稀硫酸反应得到硫酸钡沉淀和后HNO2溶液,可用过滤的方法除去硫酸钡沉淀;即用过滤从混合物中分离出HNO2溶液;
故答案为:+3;过滤;
②由氧化还原化合价升价原理可知,氮的另外一种氧化物中氮元素的化合价低于+3价,氧化剂与还原剂的物质的量之比为1:1,根据化合价升降总素相等,该氧化物为一氧化氮;
故答案为:NO;
(3)氧化产物和还原产物的物质的量之比为1:2,所以生成1个氧化产物硝酸化合价变化2,根据化合价升降总素相等,生成2个氮的氧化物化合价变化也为2,则1个氮的氧化物化合价变化为1,氮氧化物为NO,方程式为:3HNO2=2NO+H2O+HNO3;
故答案为:3HNO2=2NO+H2O+HNO3.
(2)①亚硝酸中氮的化合价为+3价,所以Ba(NO2)2中N的化合价为+3价;
由强酸制弱酸的原理可知Ba(NO2)2溶液与稀硫酸反应得到硫酸钡沉淀和后HNO2溶液,可用过滤的方法除去硫酸钡沉淀;即用过滤从混合物中分离出HNO2溶液;
故答案为:+3;过滤;
②由氧化还原化合价升价原理可知,氮的另外一种氧化物中氮元素的化合价低于+3价,氧化剂与还原剂的物质的量之比为1:1,根据化合价升降总素相等,该氧化物为一氧化氮;
故答案为:NO;
(3)氧化产物和还原产物的物质的量之比为1:2,所以生成1个氧化产物硝酸化合价变化2,根据化合价升降总素相等,生成2个氮的氧化物化合价变化也为2,则1个氮的氧化物化合价变化为1,氮氧化物为NO,方程式为:3HNO2=2NO+H2O+HNO3;
故答案为:3HNO2=2NO+H2O+HNO3.
点评:本题考查了氧化还原反应中化合价升降总数相等,产物判断,方程式的书写方法,题干信息的应用是解题关键,题目难度中等

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述错误的是( )
| A、标准状况下,5LCH4与5LNH3的原子个数之比为5:4 |
| B、常温常压下,11.2LO3中所含氧原子个数大于1.5NA |
| C、同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的质量 |
| D、同温、同压下,CO和CO2的密度比为7:11 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、在标准状况下,11.2L氖气中含有NA个氖原子 |
| B、2 mol?L-1 的Na2SO4溶液中含有4NA个Na+ |
| C、NA个水分子的相对分子质量之和等于水的摩尔质量 |
| D、常温常压下,9克水所含的电子数为5NA |
常温下,有物质的量浓度、体积都相同的NaA(pH=8)溶液和NaB(pH=12)溶液,下列说法中不正确的是( )
| A、NaA溶液中c(Na+)-c(A-)=10-6mol?L-1 |
| B、NaB溶液中c(H+)+c(HB)=10-2mol?L-1 |
| C、将两溶液混合,混合溶液中:c(OH-)>5×10-3mol?L-1 |
| D、两溶液中的离子总数不相等 |
设NA代表阿伏加德罗常数.下列有关叙述正确的是( )
| A、分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28g |
| B、常温下,1L0.1mol.L-1的NH4NO3溶液中NH4+和NO3-总数为0.2NA |
| C、标准状况下,4.48 L重水(D20)含有的中子数为2NA |
| D、1 mol甲基(-CH3)所含电子数为9NA |
关于下列各实验或装置的叙述中,正确的是( )


| A、实验①可用于制取氨气 |
| B、实验②中最后一滴NaOH标准液使溶液由无色变为红色,即达到滴定终点 |
| C、装置③可用于吸收尾气中少量NH3或HCl,并防止倒吸 |
| D、装置④可用于从酒精水溶液中制取无水乙醇 |
 滴定法是一种用于测定的非常重要的方法.
滴定法是一种用于测定的非常重要的方法.