题目内容
下列说法正确的是( )
| A、将钠投入硫酸铜溶液中只有紫红色固体析出 |
| B、过氧化钠投入硫酸亚铁溶液中出现白色沉淀 |
| C、氨水滴入氯化铝溶液中先出现白色沉淀后溶解 |
| D、饱和氯化钙溶液加入浓氢氧化钠溶液出现白色沉淀 |
考点:钠的化学性质,镁、铝的重要化合物,铁盐和亚铁盐的相互转变
专题:
分析:A.根据钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应;
B.过氧化钠具有强氧化性,可与水反应生成氢氧化钠和氧气,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,以此解答;
C.氨水和氯化铝溶液只会生成氢氧化铝和氯化铵;
D.因为氢氧化钙微溶,所以饱和氯化钙溶液加入浓氢氧化钠溶液出现白色的氢氧化钙沉淀.
B.过氧化钠具有强氧化性,可与水反应生成氢氧化钠和氧气,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,以此解答;
C.氨水和氯化铝溶液只会生成氢氧化铝和氯化铵;
D.因为氢氧化钙微溶,所以饱和氯化钙溶液加入浓氢氧化钠溶液出现白色的氢氧化钙沉淀.
解答:
解:A.钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应,所以Na不能从CuCl2溶液中置换出红色金属Cu,故A错误;
B.Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,Fe3+与氢氧化钠反应,3OH-+Fe3+=Fe(OH)3↓,立即生成红褐色的Fe(OH)3沉淀,所以最终有红褐色沉淀生成,故B错误;
C.因为氢氧化铝只与强碱反应,所以氨水和氯化铝溶液只会生成氢氧化铝和氯化铵,故C错误;
D.因为氢氧化钙微溶,所以饱和氯化钙溶液加入浓氢氧化钠溶液出现白色的氢氧化钙沉淀,故D正确;
故选D.
B.Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,氧气和Na2O2具有强氧化性,可以把Fe2+氧化为Fe3+,Fe3+与氢氧化钠反应,3OH-+Fe3+=Fe(OH)3↓,立即生成红褐色的Fe(OH)3沉淀,所以最终有红褐色沉淀生成,故B错误;
C.因为氢氧化铝只与强碱反应,所以氨水和氯化铝溶液只会生成氢氧化铝和氯化铵,故C错误;
D.因为氢氧化钙微溶,所以饱和氯化钙溶液加入浓氢氧化钠溶液出现白色的氢氧化钙沉淀,故D正确;
故选D.
点评:本题主要考查了物质的性质与制备,难度不大,注意物质性质的掌握.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
下列四种基本类型的反应中,一定不是氧化还原反应的是( )
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、0.5molAl与足量盐酸反应转移电子数为1NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为1 NA |
| D、46 g NO2和N2O4的混合物含有的分子数为1NA |
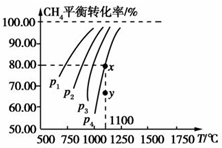 在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H>0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃,P1时该反应平衡常数约为16.4 |
| D、压强为p4时,在y点:V正>V逆 |
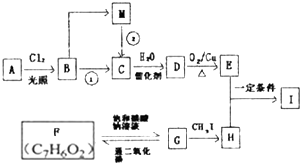
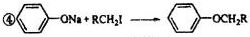
 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律
