��Ŀ����
��1���ٴ�����Na2CO3 ag����Na2CO3��NaHCO3�Ļ���� ag���۴�����NaHCO3ag����Ҫ��ش��������⣺
A���ֱ���������ȫ��Ӧʱ���������Ӵ�С��˳��Ϊ ��
B���ֱ��������ȫ��Ӧʱ���ų�CO2��������Ӵ�С��˳��Ϊ ��
��2����a g Na2CO3��NaHCO3�Ļ�����ּ��ȣ���������Ϊb g����Na2CO3����������Ϊ ��
��3�����������������ε���Һ����ŨHNO3����PbO2�����У���Һ�����Ϻ�ɫ��PbO2ת��ΪPb��NO3��2����Ӧ�����������ɣ��÷�Ӧ�����ӷ���ʽΪ ��
��4����֪��
��3Fe��s��+2O2��g��=Fe3O4��s����H1=-1118.4kJ?mol-1
��2H2��g��+O2��g��=2H2O��g����H2=-483.8kJ?mol-1
��2H2��g��+O2��g��=2H2O��l����H2=-571.8kJ?mol-1
����ˮ��Ӧ��3Fe��s��+4H2O��g��=Fe3O4��s��+4H2��H���H= ��
��5����500mL KOH��Һ�л���ͨ��һ������CO2���壬��ַ�Ӧ���ڼ�ѹ������������Һ���õ���ɫ���壮��ͨ��CO2����Ϊ2.24L����״���£����õ�11.9g�İ�ɫ���壮�����õ�KOH��Һ�����ʵ���Ũ��Ϊ mol/L��
A���ֱ���������ȫ��Ӧʱ���������Ӵ�С��˳��Ϊ
B���ֱ��������ȫ��Ӧʱ���ų�CO2��������Ӵ�С��˳��Ϊ
��2����a g Na2CO3��NaHCO3�Ļ�����ּ��ȣ���������Ϊb g����Na2CO3����������Ϊ
��3�����������������ε���Һ����ŨHNO3����PbO2�����У���Һ�����Ϻ�ɫ��PbO2ת��ΪPb��NO3��2����Ӧ�����������ɣ��÷�Ӧ�����ӷ���ʽΪ
��4����֪��
��3Fe��s��+2O2��g��=Fe3O4��s����H1=-1118.4kJ?mol-1
��2H2��g��+O2��g��=2H2O��g����H2=-483.8kJ?mol-1
��2H2��g��+O2��g��=2H2O��l����H2=-571.8kJ?mol-1
����ˮ��Ӧ��3Fe��s��+4H2O��g��=Fe3O4��s��+4H2��H���H=
��5����500mL KOH��Һ�л���ͨ��һ������CO2���壬��ַ�Ӧ���ڼ�ѹ������������Һ���õ���ɫ���壮��ͨ��CO2����Ϊ2.24L����״���£����õ�11.9g�İ�ɫ���壮�����õ�KOH��Һ�����ʵ���Ũ��Ϊ
���㣺��ѧ����ʽ���йؼ���,�ø�˹���ɽ����йط�Ӧ�ȵļ���
ר�⣺
��������1�����������������ʣ��ٴ�����Na2CO3 a g����Na2CO3��NaHCO3�Ļ����a g���۴�����NaHCO3 a g���ֱ�����������ʵ�����
��������ȫ��Ӧʱ���ֱ��г�Na2CO3��NaHCO3�����ᷴӦ�ı�����ϵʱ�����HCl������
��������ȫ��Ӧʱ���ֱ��г�Na2CO3��NaHCO3������CO2�ı�����ϵʱ�����CO2����
��2����ag Na2CO3��NaHCO3�Ļ�����ּ��ȣ�NaHCO3�ķֽⷽ��ʽ���ݲ��������⣻
��3����������֪���ڷ�Ӧ��PbO2�õ���ת��ΪΪPb��NO3��2�����Զ�����Ǧ�����������������ʧ��������ԭ������Һ�ʺ�ɫ��˵�����������ӱ��������ɸ���������ӣ����ݷ�Ӧ���������д����Ӧ�����ӷ���ʽ��
��4�������Ȼ�ѧ����ʽ����д��������ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ�д�������ݸ�˹���ɼ��㷴Ӧ���ʱ䣻
��5��2.24L������£�CO2��������ʵ���Ϊ0.1mol��������̼��ȫ��Ӧ��
��ֻ������CO2+2KOH=K2CO3+H2O��������0.1mol��K2CO3��������=0.1mol��138g/mol=13.8g��
��ֻ������CO2+KOH=KHCO3��������0.1mol��KHCO3��������=0.1mol��100g/mol=10g��
����13.8g��11.9g��10.0g�����Եõ��İ�ɫ������K2CO3��KHCO3�Ļ���
���ɫ������K2CO3 x mol��KHCO3 y mol������CԪ���غ㼰���������з��̼��㣬�ٸ��ݼ������غ����KOH���ʵ���������c=
����KOH��Һ���ʵ���Ũ�ȣ�
��������ȫ��Ӧʱ���ֱ��г�Na2CO3��NaHCO3�����ᷴӦ�ı�����ϵʱ�����HCl������
��������ȫ��Ӧʱ���ֱ��г�Na2CO3��NaHCO3������CO2�ı�����ϵʱ�����CO2����
��2����ag Na2CO3��NaHCO3�Ļ�����ּ��ȣ�NaHCO3�ķֽⷽ��ʽ���ݲ��������⣻
��3����������֪���ڷ�Ӧ��PbO2�õ���ת��ΪΪPb��NO3��2�����Զ�����Ǧ�����������������ʧ��������ԭ������Һ�ʺ�ɫ��˵�����������ӱ��������ɸ���������ӣ����ݷ�Ӧ���������д����Ӧ�����ӷ���ʽ��
��4�������Ȼ�ѧ����ʽ����д��������ע���ʾۼ�״̬�Ͷ�Ӧ�ʱ�д�������ݸ�˹���ɼ��㷴Ӧ���ʱ䣻
��5��2.24L������£�CO2��������ʵ���Ϊ0.1mol��������̼��ȫ��Ӧ��
��ֻ������CO2+2KOH=K2CO3+H2O��������0.1mol��K2CO3��������=0.1mol��138g/mol=13.8g��
��ֻ������CO2+KOH=KHCO3��������0.1mol��KHCO3��������=0.1mol��100g/mol=10g��
����13.8g��11.9g��10.0g�����Եõ��İ�ɫ������K2CO3��KHCO3�Ļ���
���ɫ������K2CO3 x mol��KHCO3 y mol������CԪ���غ㼰���������з��̼��㣬�ٸ��ݼ������غ����KOH���ʵ���������c=
| n |
| V |
���
�⣺��1�����������������ʣ��ٴ�����Na2CO3 a g�����ʵ���Ϊ
mol����Na2CO3��NaHCO3�Ļ����a g�����ʵ���Ϊ
mol��
mol֮�䣻
�۴�����NaHCO3 a g�����ʵ���Ϊ
mol
A����������ȫ��Ӧʱ����Na2CO3------------2HCl��NaHCO3------------HCl
mol
mol
mol
mol
�ʴ�Ϊ���٣��ڣ��ۣ�
B����������ȫ��Ӧʱ����Na2CO3------------CO2��NaHCO3------------CO2
mol
mol
mol
mol
�ʴ�Ϊ���ۣ��ڣ��٣�
��2����ag Na2CO3��NaHCO3�Ļ�����ּ��ȣ���2NaHCO3
Na2CO3+CO2��+H2O��m
168 62
m ag-bg
m=
����Na2CO3�������ֱ�Ϊ��ag-m=ag-
��
��Na2CO3��������������1-
����100%���ʴ�Ϊ����1-
����100%��
��3����������֪���ڷ�Ӧ��PbO2�õ���ת��ΪΪPb��NO3��2�����Զ�����Ǧ�����������������ʧ��������ԭ������Һ�ʺ�ɫ��˵�����������ӱ��������ɸ���������ӣ����Է�Ӧ�����ӷ���ʽΪ 2Mn2++4H++5PbO2=5Pb2++2MnO4-+2H2O��
�ʴ�Ϊ��2Mn2++4H++5PbO2=5Pb2++2MnO4-+2H2O��
��4����֪��
��3Fe��s��+2O2��g��?Fe3O4��s����H 1=-1118.4KJ/mol��
��2H2��g��+O2��g��?2H2O��g����H 1=-483.8KJ/mol��
��2H2��g��+O��g��?2H2O��l����H 1=-571.8KJ/mol��
���ݸ�˹���ɿ�֪����-�ڡ�2�ã�3Fe��s��+4H2O��g��?Fe3O4��s��+4H2��g��
��H=��H 1-2��H2=-1118.4+483.8��2=-150.8KJ/mol��
�ʴ�Ϊ��-150.8KJ/mol��
��5��2.24L������£�CO2��������ʵ���Ϊ
=0.1mol��
��ֻ������CO2+2KOH=K2CO3+H2O��������0.1mol��K2CO3��������=0.1mol��138g/mol=13.8g��
��ֻ������CO2+KOH=KHCO3��������0.1mol��KHCO3��������=0.1mol��100g/mol=10g��
����13.8g��11.9g��10.0g�����Եõ��İ�ɫ������K2CO3��KHCO3�Ļ���
���ɫ������K2CO3 x mol��KHCO3 y mol��
����̼ԭ���غ㣬�У�x mol+y mol=0.1 mol��
�ɶ���������֪��138g?mol-1��x mol+100 g?mol-1��y mol=11.9g
�������̣����x=0.05mol y=0.05mol
ԭ��Һ��KOH���ʵ���Ϊ 2xmol+ymol=2��0.05mol+0.05mol=0.15mol������KOH��Һ���ʵ���Ũ��Ϊ
=0.3mol?L-1��
�ʴ�Ϊ��0.3��
| a |
| 106 |
| a |
| 106 |
| a |
| 84 |
�۴�����NaHCO3 a g�����ʵ���Ϊ
| a |
| 84 |
A����������ȫ��Ӧʱ����Na2CO3------------2HCl��NaHCO3------------HCl
| a |
| 106 |
| a |
| 53 |
| a |
| 84 |
| a |
| 84 |
�ʴ�Ϊ���٣��ڣ��ۣ�
B����������ȫ��Ӧʱ����Na2CO3------------CO2��NaHCO3------------CO2
| a |
| 106 |
| a |
| 106 |
| a |
| 84 |
| a |
| 84 |
�ʴ�Ϊ���ۣ��ڣ��٣�
��2����ag Na2CO3��NaHCO3�Ļ�����ּ��ȣ���2NaHCO3
| ||
168 62
m ag-bg
m=
| 168(a-b)g |
| 62 |
| 168(a-b)g |
| 62 |
��Na2CO3��������������1-
| 84(a-b) |
| 31a |
| 84(a-b) |
| 31a |
��3����������֪���ڷ�Ӧ��PbO2�õ���ת��ΪΪPb��NO3��2�����Զ�����Ǧ�����������������ʧ��������ԭ������Һ�ʺ�ɫ��˵�����������ӱ��������ɸ���������ӣ����Է�Ӧ�����ӷ���ʽΪ 2Mn2++4H++5PbO2=5Pb2++2MnO4-+2H2O��
�ʴ�Ϊ��2Mn2++4H++5PbO2=5Pb2++2MnO4-+2H2O��
��4����֪��
��3Fe��s��+2O2��g��?Fe3O4��s����H 1=-1118.4KJ/mol��
��2H2��g��+O2��g��?2H2O��g����H 1=-483.8KJ/mol��
��2H2��g��+O��g��?2H2O��l����H 1=-571.8KJ/mol��
���ݸ�˹���ɿ�֪����-�ڡ�2�ã�3Fe��s��+4H2O��g��?Fe3O4��s��+4H2��g��
��H=��H 1-2��H2=-1118.4+483.8��2=-150.8KJ/mol��
�ʴ�Ϊ��-150.8KJ/mol��
��5��2.24L������£�CO2��������ʵ���Ϊ
| 2.24L |
| 22.4L/mol |
��ֻ������CO2+2KOH=K2CO3+H2O��������0.1mol��K2CO3��������=0.1mol��138g/mol=13.8g��
��ֻ������CO2+KOH=KHCO3��������0.1mol��KHCO3��������=0.1mol��100g/mol=10g��
����13.8g��11.9g��10.0g�����Եõ��İ�ɫ������K2CO3��KHCO3�Ļ���
���ɫ������K2CO3 x mol��KHCO3 y mol��
����̼ԭ���غ㣬�У�x mol+y mol=0.1 mol��
�ɶ���������֪��138g?mol-1��x mol+100 g?mol-1��y mol=11.9g
�������̣����x=0.05mol y=0.05mol
ԭ��Һ��KOH���ʵ���Ϊ 2xmol+ymol=2��0.05mol+0.05mol=0.15mol������KOH��Һ���ʵ���Ũ��Ϊ
| 0.15mol |
| 0.5L |
�ʴ�Ϊ��0.3��
���������⿼��Na2CO3��NaHCO3���ʵ���ͬ����˹���ɵ�Ӧ�ã����ݷ���ʽ�ļ���ȣ���Ҫ���鷴Ӧ�Ķ�����ϵ����ͱȽϣ��е��Ѷȣ�

��ϰ��ϵ�д�
�����Ŀ
����˵����ȷ���ǣ�������
| A������Ͷ������ͭ��Һ��ֻ���Ϻ�ɫ�������� |
| B����������Ͷ������������Һ�г��ְ�ɫ���� |
| C����ˮ�����Ȼ�����Һ���ȳ��ְ�ɫ�������ܽ� |
| D�������Ȼ�����Һ����Ũ����������Һ���ְ�ɫ���� |
�����й�ʵ�����������ȷ���ǣ�������
| A����Һʱ����Һ©�����ϲ�Һ��Ӧ���Ͽڵ��� |
| B���ü��ȷֽ�ķ�������̼���ƺ�̼���������ֹ��� |
| C������0.1000 mol?L-1����������Һʱ����Һ��ת�Ƶ�����ƿ�����ò��������� |
| D���������ʱ���������е�ˮӦ���Ͻ��³� |
����ȷ��ʾ���з�Ӧ�����ӷ���ʽΪ��������
| A��̼���Ƶ�ˮ�ⷴӦ��CO32-+H3O+�THCO3-+H2O |
| B������ʯ���ڴ����У�CaCO3+2H+=Ca2++H2O+CO2�� |
| C������������������ϣ�Fe��OH��3+3H+=Fe3++3H2O |
| D����ƫ��������Һ��ͨ�����������̼��AlO2-+CO2+2H2O=Al��OH��3��+HCO3- |
����˵������ȷ���ǣ�������
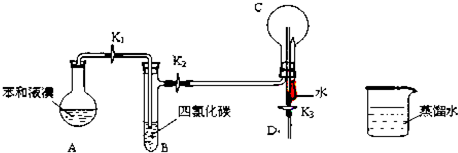
A��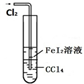 �������ڱȽ�Fe3+��I2��Cl2��������ǿ�� |
B��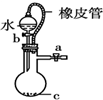 ��Ƥ�ܵ�������ʹˮ��˳������ |
C�� ����Ba��OH��2��Һ����μ���������Һֱ���������ƹ�������䰵��Ϩ��������� |
D��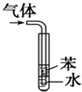 ��������HCl�����ܷ����� |
��FeCl3��Һ��ʴӡˢ��·���ϵ�ͭ�����õ���Һ�м������ۣ��Լ������۳�ַ�Ӧ�����Һ�����������ǣ�������
| A��������ʣ�࣬����Һ��һ����Fe3+ |
| B������Һ����Cu2+����һ��û�й������� |
| C�����й�����ڣ�����Һ��һ����Fe2+ |
| D������Һ����Fe2+����һ����Cu���� |
��ѧ������ѧϰ��ѧ����Ҫ���ߣ�����������ʾ���ʱ仯�Ļ�ѧ�����У���ȷ���ǣ�������
| A���ö��Ե缫��ⱥ��ʳ��ˮʱ�������ĵ缫��ӦʽΪ2Cl--2e-�TCl2�� |
| B������ȼ�ϵ�صĸ�����Ӧʽ��O2+2H2O+4e-�T4OH- |
| C����ͭ����ʱ�����Դ�����������Ǵ�ͭ��������ӦʽΪCu-2e-�TCu2+ |
| D�����������绯ѧ��ʴ��������Ӧʽ��Fe-2e-�TFe2+ |