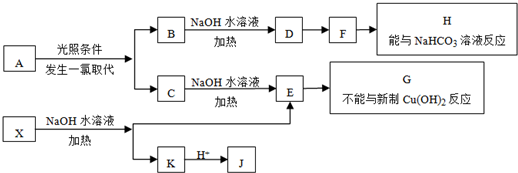
题目内容
用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、0.5molAl与足量盐酸反应转移电子数为1NA |
| B、标准状况下,11.2L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为1 NA |
| D、46 g NO2和N2O4的混合物含有的分子数为1NA |
考点:阿伏加德罗常数
专题:
分析:A.铝为3价金属,0.5mol铝完全反应失去1.5mol电子;
B.标况下三氧化硫的状态不是气体,不能使用气体摩尔体积计算三氧化硫的物质的量;
C.甲烷分子中含有10个电子,0.1mol甲烷中含有1mol电子;
D.NO2和N2O4的摩尔质量不同,无法计算混合物中含有的分子数.
B.标况下三氧化硫的状态不是气体,不能使用气体摩尔体积计算三氧化硫的物质的量;
C.甲烷分子中含有10个电子,0.1mol甲烷中含有1mol电子;
D.NO2和N2O4的摩尔质量不同,无法计算混合物中含有的分子数.
解答:
解:A.0.5mol铝完全反应失去1.5mol电子,转移电子数为1.5NA,故A错误;
B.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算11.2L三氧化硫的物质的量,故B错误;
C.0.1mol甲烷分子中含有1mol电子,所含的电子数为1NA,故C正确;
D.二氧化氮的摩尔质量为46g/mol,N2O4的摩尔质量为92g/mol,无法计算46g混合物的物质的量,故D错误;
故选C.
B.标况下三氧化硫不是气体,不能使用标况下的气体摩尔体积计算11.2L三氧化硫的物质的量,故B错误;
C.0.1mol甲烷分子中含有1mol电子,所含的电子数为1NA,故C正确;
D.二氧化氮的摩尔质量为46g/mol,N2O4的摩尔质量为92g/mol,无法计算46g混合物的物质的量,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
在强碱性溶液中能大量共存,且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Cl-、Ba2+ |
| B、Na+、Ba2+、HCO3-、NO3- |
| C、K+、NO3-、CO32-、Cl- |
| D、Na+、H+、Cl-、S2- |
下列说法正确的是( )
| A、将钠投入硫酸铜溶液中只有紫红色固体析出 |
| B、过氧化钠投入硫酸亚铁溶液中出现白色沉淀 |
| C、氨水滴入氯化铝溶液中先出现白色沉淀后溶解 |
| D、饱和氯化钙溶液加入浓氢氧化钠溶液出现白色沉淀 |
下列有关实验的做法不正确的是( )
| A、分液时,分液漏斗的上层液体应由上口倒出 |
| B、用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 |
| C、配置0.1000 mol?L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 |
| D、蒸馏操作时,冷凝管中的水应该上进下出 |
能正确表示下列反应的离子方程式为( )
| A、碳酸钠的水解反应:CO32-+H3O+═HCO3-+H2O |
| B、大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、氢氧化铁与氢碘酸混合:Fe(OH)3+3H+=Fe3++3H2O |
| D、向偏铝酸钠溶液中通入过量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
一定条件下,在体积为1L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )
| A、X的百分含量不再发生变化 |
| B、c(X):c(Y):c(Z)=2:1:1 |
| C、容器内气体的质量不再发生变化 |
| D、同一时间内消耗2n mol X的同时生成n mol Z |
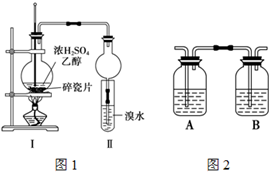 某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.