题目内容
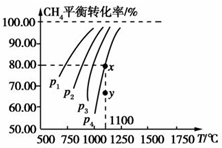 在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )
在2L的恒容密闭容器中,充入0.2molCO2和0.2molCH4,在一定条件下发生反应:CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( )| A、上述反应的△H>0 |
| B、压强:P4>P3>P2>P1 |
| C、1100℃,P1时该反应平衡常数约为16.4 |
| D、压强为p4时,在y点:V正>V逆 |
考点:转化率随温度、压强的变化曲线
专题:
分析:A、随温度的升高转化率增大;
B、增大压强,平衡向气体体积减小的方向移动;
C、利用三段式计算出平衡时的浓度求算;
D、y点时甲烷的转化率小,平衡正向移动.
B、增大压强,平衡向气体体积减小的方向移动;
C、利用三段式计算出平衡时的浓度求算;
D、y点时甲烷的转化率小,平衡正向移动.
解答:
解:A、从图象分析,随温度升高转化率增大,正反应吸热,故A正确;
B、压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故P4>P3>P2>P1,故B正确;
C、反应 CH4(g)+CO2(g)?2CO(g)+2H2(g),
起始(mol/L) 0.1 0.1 0 0
变化(mol/L) 0.08 0.08 0.16 0.16
平衡(mol/L) 0.02 0.02 0.16 0.16
平衡常数K=
=1.64≠16.4,故C错误;
D、在y点,甲烷的转化率小于平衡时的转化率,平衡正向移动,V正>V逆,故D正确.
故选C.
B、压强增大,平衡向逆反应方向移动,甲烷的转化率变小,故P4>P3>P2>P1,故B正确;
C、反应 CH4(g)+CO2(g)?2CO(g)+2H2(g),
起始(mol/L) 0.1 0.1 0 0
变化(mol/L) 0.08 0.08 0.16 0.16
平衡(mol/L) 0.02 0.02 0.16 0.16
平衡常数K=
| 0.162×0.162 |
| 0.02×0.02 |
D、在y点,甲烷的转化率小于平衡时的转化率,平衡正向移动,V正>V逆,故D正确.
故选C.
点评:本题考查了平衡受温度、压强的影响而移动的问题,注意看准图象是解题的关键,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、将钠投入硫酸铜溶液中只有紫红色固体析出 |
| B、过氧化钠投入硫酸亚铁溶液中出现白色沉淀 |
| C、氨水滴入氯化铝溶液中先出现白色沉淀后溶解 |
| D、饱和氯化钙溶液加入浓氢氧化钠溶液出现白色沉淀 |
下列说法不正确的是( )
A、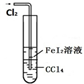 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
B、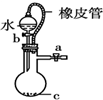 橡皮管的作用是使水能顺利流下 |
C、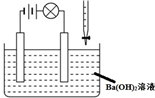 若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 |
D、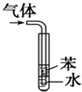 用于吸收HCl气体能防倒吸 |
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉.对加入铁粉充分反应后的溶液分析合理的是( )
| A、若无固体剩余,则溶液中一定有Fe3+ |
| B、若溶液中有Cu2+,则一定没有固体析出 |
| C、若有固体存在,则溶液中一定有Fe2+ |
| D、若溶液中有Fe2+,则一定有Cu析出 |
下列实验操作中和事故、药品的处理中正确的是( )
| A、“粗盐提纯“的实验中,当蒸发皿中出现较多固体时,停止加热 |
| B、少量浓硫酸沾在皮肤上立即用氢氧化钠冲洗 |
| C、有腐蚀性D的药品直接放在天平托盘上称重 |
| D、提取溴水中的溴时,可以选择酒精灯、作萃取剂 |
一定条件下,在体积为1L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)?Z(g),下列叙述能证明该反应已达到化学平衡状态的是( )
| A、X的百分含量不再发生变化 |
| B、c(X):c(Y):c(Z)=2:1:1 |
| C、容器内气体的质量不再发生变化 |
| D、同一时间内消耗2n mol X的同时生成n mol Z |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
