题目内容
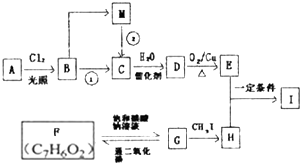
查尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下:
已知以下信息:
①芳香烃A能与酸性高锰酸钾反应生成苯甲酸,其相对分子质量在100-110之间,符合CnH2n-6的通式.B为一氯取代物.
②E不能与新制氢氧化铜悬浊液反应,E的一种同分异构体可由M催化氧化得到
③F是芳香族化合物,能发生银镜反应、可溶于NaOH溶液、苯环上的一氯取代物只有2种
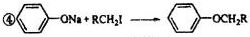
⑤RCOCH3+R′CHO
RCOCH=CHR′
回答下列问题;
(1)A的化学名称为 .
(2)由B生成C、由M生成C的反应条件分别是① ,② .
(3)由G生成H的反应类型为 ,I的结构简式为 .
(4)F的芳香同分异构体N既能发生银镜反应,又能发生水解反应,N在酸催化下发生水解反应的化学方程式为 .
(5)H的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有13种,其中有5种不同化学环境的氢,其个数比为2:2:2:1:1的为 (写结构简式).

已知以下信息:
①芳香烃A能与酸性高锰酸钾反应生成苯甲酸,其相对分子质量在100-110之间,符合CnH2n-6的通式.B为一氯取代物.
②E不能与新制氢氧化铜悬浊液反应,E的一种同分异构体可由M催化氧化得到
③F是芳香族化合物,能发生银镜反应、可溶于NaOH溶液、苯环上的一氯取代物只有2种
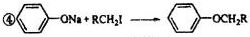
⑤RCOCH3+R′CHO
| 一定条件 |
回答下列问题;
(1)A的化学名称为
(2)由B生成C、由M生成C的反应条件分别是①
(3)由G生成H的反应类型为
(4)F的芳香同分异构体N既能发生银镜反应,又能发生水解反应,N在酸催化下发生水解反应的化学方程式为
(5)H的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有13种,其中有5种不同化学环境的氢,其个数比为2:2:2:1:1的为
考点:有机物的推断
专题:有机物的化学性质及推断
分析:芳香烃A的相对分子质量在100~110之间,符合CnH2n-6的通式,则100<14n-6<110,则n=8,故A的分子式为C8H10,芳香烃A能与酸性高锰酸钾反应生成苯甲酸,则A为 ,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为
,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为 ,D为
,D为 ,E为
,E为 .E的一种同分异构体可由M催化氧化得到,则M为
.E的一种同分异构体可由M催化氧化得到,则M为 ,故B为
,故B为 .
.
F是芳香族化合物,分子式为C7H6O2,能发生银镜反应,可溶于NaOH溶液,则含有-CHO、酚羟基,苯环上的一氯取代物只有2种,2个不同取代基处于对位,故F为 ,与饱和的碳酸钠溶液反应生成G为
,与饱和的碳酸钠溶液反应生成G为 ,G与CH3I发生信息④中的取代反应生成H为
,G与CH3I发生信息④中的取代反应生成H为 ,E与H发生信息⑤中反应生成生成I为
,E与H发生信息⑤中反应生成生成I为 ,据此解答.
,据此解答.
 ,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为
,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为 ,D为
,D为 ,E为
,E为 .E的一种同分异构体可由M催化氧化得到,则M为
.E的一种同分异构体可由M催化氧化得到,则M为 ,故B为
,故B为 .
.F是芳香族化合物,分子式为C7H6O2,能发生银镜反应,可溶于NaOH溶液,则含有-CHO、酚羟基,苯环上的一氯取代物只有2种,2个不同取代基处于对位,故F为
 ,与饱和的碳酸钠溶液反应生成G为
,与饱和的碳酸钠溶液反应生成G为 ,G与CH3I发生信息④中的取代反应生成H为
,G与CH3I发生信息④中的取代反应生成H为 ,E与H发生信息⑤中反应生成生成I为
,E与H发生信息⑤中反应生成生成I为 ,据此解答.
,据此解答.解答:
解:芳香烃A的相对分子质量在100~110之间,符合CnH2n-6的通式,则100<14n-6<110,则n=8,故A的分子式为C8H10,芳香烃A能与酸性高锰酸钾反应生成苯甲酸,则A为 ,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为
,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为 ,D为
,D为 ,E为
,E为 .E的一种同分异构体可由M催化氧化得到,则M为
.E的一种同分异构体可由M催化氧化得到,则M为 ,故B为
,故B为 .
.
F是芳香族化合物,分子式为C7H6O2,能发生银镜反应,可溶于NaOH溶液,则含有-CHO、酚羟基,苯环上的一氯取代物只有2种,2个不同取代基处于对位,故F为 ,与饱和的碳酸钠溶液反应生成G为
,与饱和的碳酸钠溶液反应生成G为 ,G与CH3I发生信息④中的取代反应生成H为
,G与CH3I发生信息④中的取代反应生成H为 ,E与H发生信息⑤中反应生成生成I为
,E与H发生信息⑤中反应生成生成I为 ,
,
(1)由上述分析可知,A为 ,化学名称为乙苯,故答案为:乙苯;
,化学名称为乙苯,故答案为:乙苯;
(2)由B生成C的反应条件为:氢氧化钠醇溶液、加热,由M生成C的反应条件为:浓硫酸、加热,
故答案为:氢氧化钠醇溶液、加热;
(3)由G生成H是 与CH3I发生取代反应生成
与CH3I发生取代反应生成 ,由上述分析可知,I的结构简式为:
,由上述分析可知,I的结构简式为: ,
,
故答案为:取代反应; ;
;
(4)F( )的芳香同分异构体N既能发生银镜反应,又能发生水解反应,N为
)的芳香同分异构体N既能发生银镜反应,又能发生水解反应,N为 ,N在酸催化下发生水解反应的化学方程式为:
,N在酸催化下发生水解反应的化学方程式为: ,
,
故答案为: ;
;
(5)H( )的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有13种,含有醛基、酚羟基,其中有5种不同化学环境的氢,其个数比为2:2:2:1:1的结构简式为
)的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有13种,含有醛基、酚羟基,其中有5种不同化学环境的氢,其个数比为2:2:2:1:1的结构简式为 ,故答案为:
,故答案为: .
.
 ,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为
,B转化得到C,C能与水反应得到D,D发生氧化反应得到E,则B在氢氧化钠醇溶液、加热条件下发生消去反应生成D,D与水发生加成反应生成D,且羟基连接氢原子较少的碳原子上,故C为 ,D为
,D为 ,E为
,E为 .E的一种同分异构体可由M催化氧化得到,则M为
.E的一种同分异构体可由M催化氧化得到,则M为 ,故B为
,故B为 .
.F是芳香族化合物,分子式为C7H6O2,能发生银镜反应,可溶于NaOH溶液,则含有-CHO、酚羟基,苯环上的一氯取代物只有2种,2个不同取代基处于对位,故F为
 ,与饱和的碳酸钠溶液反应生成G为
,与饱和的碳酸钠溶液反应生成G为 ,G与CH3I发生信息④中的取代反应生成H为
,G与CH3I发生信息④中的取代反应生成H为 ,E与H发生信息⑤中反应生成生成I为
,E与H发生信息⑤中反应生成生成I为 ,
,(1)由上述分析可知,A为
 ,化学名称为乙苯,故答案为:乙苯;
,化学名称为乙苯,故答案为:乙苯;(2)由B生成C的反应条件为:氢氧化钠醇溶液、加热,由M生成C的反应条件为:浓硫酸、加热,
故答案为:氢氧化钠醇溶液、加热;
(3)由G生成H是
 与CH3I发生取代反应生成
与CH3I发生取代反应生成 ,由上述分析可知,I的结构简式为:
,由上述分析可知,I的结构简式为: ,
,故答案为:取代反应;
 ;
;(4)F(
 )的芳香同分异构体N既能发生银镜反应,又能发生水解反应,N为
)的芳香同分异构体N既能发生银镜反应,又能发生水解反应,N为 ,N在酸催化下发生水解反应的化学方程式为:
,N在酸催化下发生水解反应的化学方程式为: ,
,故答案为:
 ;
;(5)H(
 )的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有13种,含有醛基、酚羟基,其中有5种不同化学环境的氢,其个数比为2:2:2:1:1的结构简式为
)的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有13种,含有醛基、酚羟基,其中有5种不同化学环境的氢,其个数比为2:2:2:1:1的结构简式为 ,故答案为:
,故答案为: .
.
点评:本题考查有机物的推断,计算确定A的为乙苯,再结合转化关系推断,需要学生熟练掌握官能团的性质与转化,需要学生对给予的信息进行利用,较好的考查学生自学能力、分析推理能力,难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
将1mol A和3mol B充入V L某密闭容器内发生反应:A(g)+B(g)?3C(g),2min时,c(A)=0.6mol?L-1,平均反应速率v(C)=0.6mol?L-1?min-1,则该容器的体积V的值为( )
| A、0.2 | B、0.5 | C、1 | D、2 |
下列说法正确的是( )
| A、将钠投入硫酸铜溶液中只有紫红色固体析出 |
| B、过氧化钠投入硫酸亚铁溶液中出现白色沉淀 |
| C、氨水滴入氯化铝溶液中先出现白色沉淀后溶解 |
| D、饱和氯化钙溶液加入浓氢氧化钠溶液出现白色沉淀 |
 ⑥
⑥ ⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl
⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl