题目内容
若溶液中由水电离产生的c(OH-)=1×10-14 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、K+、NH4+、SO42-、NO3- |
| B、Ca2+、Al3+、HCO3-、Cl- |
| C、MnO4-、K+、SO42-、Na+ |
| D、Na+、Fe2+、NO3-、SCN- |
考点:离子共存问题
专题:离子反应专题
分析:溶液中由水电离产生的c(OH-)=1×10-14 mol/L,该溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.若为碱性溶液,铵根离子与氢氧根离子反应生成一水合氨;
B.铝离子与碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
C.MnO4-、K+、SO42-、Na+离子之间不发生反应,都不与氢离子和氢氧根离子反应;
D.酸性溶液中,Fe2+、NO3-之间发生氧化还原反应.
A.若为碱性溶液,铵根离子与氢氧根离子反应生成一水合氨;
B.铝离子与碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
C.MnO4-、K+、SO42-、Na+离子之间不发生反应,都不与氢离子和氢氧根离子反应;
D.酸性溶液中,Fe2+、NO3-之间发生氧化还原反应.
解答:
解:由水电离产生的c(OH-)=1×10-14 mol/L的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.碱性溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应生成弱电解质一水合氨,在溶液中不能大量共存,故A错误;
B.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故B错误;
C.MnO4-、K+、SO42-、Na+之间不反应,且都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.酸性溶液中存在大量氢离子,在酸性条件下Fe2+、NO3-之间能够发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选C.
A.碱性溶液中存在大量氢氧根离子,NH4+与氢氧根离子反应生成弱电解质一水合氨,在溶液中不能大量共存,故A错误;
B.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,在溶液中不能大量共存,故B错误;
C.MnO4-、K+、SO42-、Na+之间不反应,且都不与氢离子、氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.酸性溶液中存在大量氢离子,在酸性条件下Fe2+、NO3-之间能够发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、糖类、油脂、蛋白质完全燃烧只生成CO2 和H2O |
| B、丁烷(C4H10)和二氯甲烷都存在同分异构体 |
| C、向溴水中加入苯,振荡静置后观察下层几乎无色 |
| D、汽油、柴油、植物油都是碳氢化合物 |


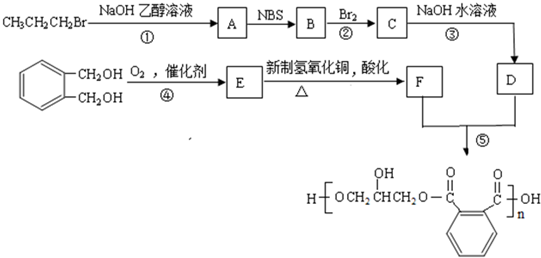
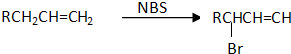
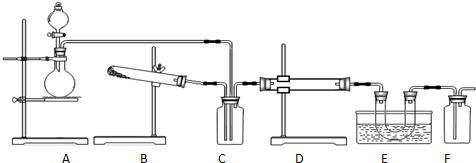
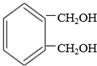 互为同分异构体的结构简式
互为同分异构体的结构简式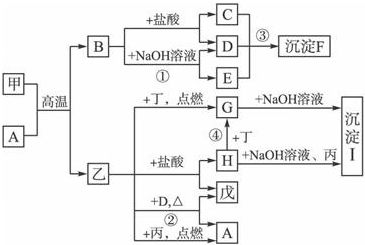 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
 的香料物质.
的香料物质.