题目内容
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍.一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团.且B的核磁共振氢谱显示有3组不同的峰.
(1)A的分子式是 .
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是 (填序号).
A.C5H12O3 B.C4H10 C.C6H10O4 D.C5H10O
(3)①B的结构简式是 .
②A不能发生的反应是 (填序号).
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: .
(5)写出B与乙二酸发生缩聚反应的化学方程式 .
(1)A的分子式是
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是
A.C5H12O3 B.C4H10 C.C6H10O4 D.C5H10O
(3)①B的结构简式是
②A不能发生的反应是
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是:
(5)写出B与乙二酸发生缩聚反应的化学方程式
考点:有机物的推断
专题:有机物的化学性质及推断
分析:有机物A含氢的质量分数为9.8%,则分子中含有的N(H)=
=10,分子中氢原子个数为氧个数的5倍,则N(O)=
=5,N(C)=
=5,所以有机物A的分子式为C5H10O2,不饱和度为1,一定条件下,A与一定氢气反应生成B,B分子的结构可视为一个碳原子上连接两个甲基和另外两个结构相同的基团,则B为 ,则A为
,则A为 ,据此解答.
,据此解答.
| 102×9.8% |
| 1 |
| 10 |
| 2 |
| 102-10-16×2 |
| 12 |
 ,则A为
,则A为 ,据此解答.
,据此解答.解答:
解:有机物A含氢的质量分数为9.8%,则分子中含有的N(H)=
=10,分子中氢原子个数为氧个数的5倍,则N(O)=
=5,N(C)=
=5,所以有机物A的分子式为C5H10O2,不饱和度为1,一定条件下,A与一定氢气反应生成B,B分子的结构可视为一个碳原子上连接两个甲基和另外两个结构相同的基团,则B为 ,则A为
,则A为 ,
,
(1)由上述分析可知,A的分子式是C5H10O2,故答案为:C5H10O2;
(2)设烃及烃的含氧衍生物组成通式为CxHyOz,总物质的量一定时,以任意比混合,有机物完全燃烧消耗氧气的物质的量和生成水的物质的量不变,则化学式中的氢原子个数相同,每摩尔有机物耗氧量(x+
-
)mol相同即符合题意,符合条件的有机物是C4H10和C6H10O4,故选BC;
(3)①符合条件的B的结构简式是 ,故答案为:
,故答案为: ;
;
②A为 ,其中含有羟基,能发生取代反应,酯化反应,易被氧化剂氧化,但是羟基的邻位碳原子上没有氢原子,所以不会发生消去反应,含有醛基,可以发生还原反应,故选:B;
,其中含有羟基,能发生取代反应,酯化反应,易被氧化剂氧化,但是羟基的邻位碳原子上没有氢原子,所以不会发生消去反应,含有醛基,可以发生还原反应,故选:B;
(4)A的一种酯类同分异构体,在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,符合条件的结构简式为:CH3COOCH(CH3)2,故答案为:CH3COOCH(CH3)2;
(5)B与乙二酸发生缩聚反应的化学方程式为: ,
,
故答案为: .
.
| 102×9.8% |
| 1 |
| 10 |
| 2 |
| 102-10-16×2 |
| 12 |
 ,则A为
,则A为 ,
,(1)由上述分析可知,A的分子式是C5H10O2,故答案为:C5H10O2;
(2)设烃及烃的含氧衍生物组成通式为CxHyOz,总物质的量一定时,以任意比混合,有机物完全燃烧消耗氧气的物质的量和生成水的物质的量不变,则化学式中的氢原子个数相同,每摩尔有机物耗氧量(x+
| y |
| 4 |
| z |
| 2 |
(3)①符合条件的B的结构简式是
 ,故答案为:
,故答案为: ;
;②A为
 ,其中含有羟基,能发生取代反应,酯化反应,易被氧化剂氧化,但是羟基的邻位碳原子上没有氢原子,所以不会发生消去反应,含有醛基,可以发生还原反应,故选:B;
,其中含有羟基,能发生取代反应,酯化反应,易被氧化剂氧化,但是羟基的邻位碳原子上没有氢原子,所以不会发生消去反应,含有醛基,可以发生还原反应,故选:B;(4)A的一种酯类同分异构体,在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,符合条件的结构简式为:CH3COOCH(CH3)2,故答案为:CH3COOCH(CH3)2;
(5)B与乙二酸发生缩聚反应的化学方程式为:
 ,
,故答案为:
 .
.
点评:本题考查有机物推断、官能团的结构与性质、同分异构体书写、有机反应方程式等,题目难度中等,需要学生熟练掌握有机化学基础.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
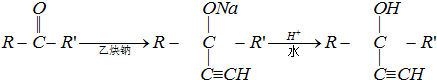
 (碳碳双键)在一定条件下与氧化剂作用,如:
(碳碳双键)在一定条件下与氧化剂作用,如:
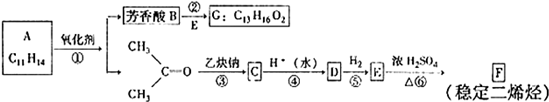
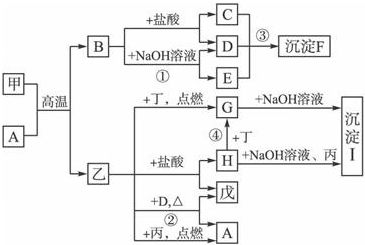 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.

 卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
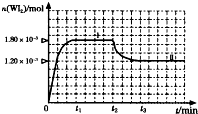
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义. 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示: A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.