题目内容
由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子.已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1molB离子与1mol E离子作用可生成2molD分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解.
(1)微粒A的电子式是 ;微粒E的名称是 .构成微粒F的元素在元素周期表中的位置是 .
(2)写出下列反应的离子方程式:
F+过量C溶液: ;
W+含大量B离子的溶液:
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀 b.有刺激性气味气体放出 c.沉淀逐渐增多 d.沉淀完全消失 e.沉淀逐渐减少
①该复盐在溶液中的电离方程式是 .
②上述各实验现象由先到后出现的正确顺序是(填写序号) .
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1molB离子与1mol E离子作用可生成2molD分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解.
(1)微粒A的电子式是
(2)写出下列反应的离子方程式:
F+过量C溶液:
W+含大量B离子的溶液:
(3)六种微粒中的两种可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓苛性钠溶液,产生的现象有:a.溶液中出现白色沉淀 b.有刺激性气味气体放出 c.沉淀逐渐增多 d.沉淀完全消失 e.沉淀逐渐减少
①该复盐在溶液中的电离方程式是
②上述各实验现象由先到后出现的正确顺序是(填写序号)
考点:位置结构性质的相互关系应用,原子核外电子排布
专题:元素周期律与元素周期表专题
分析:由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子.已知A、E是由非金属元素组成的阳离子,
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝,则C是氨气;
①A、B两种离子在加热条件下可生成C、D两种分子,A是10电子的阳离子,能生成氨气,则A是铵根离子,B是氢氧根离子,D是水;
③1molB离子与1molE离子作用可生成2mol D分子,则E是水合氢离子;
④向含F离子的溶液中加入氨气的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解则F是铝离子,沉淀W是氢氧化铝.
(1)通过以上分析知,A的化学式为:NH4+,E是水合氢离子,F是铝离子,在周期表中位于第三周期第IIIA族;
(2)铝离子和氨水反应生成氢氧化铝和铵根离子,离子反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
氢氧化铝和氢氧根离子反应生成偏铝酸根离子和水,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O;
(3)a.溶液中出现白色沉淀,c.沉淀逐渐增多,e.沉淀逐渐减少,d.沉淀完全消失,说明此沉淀为Al(OH)3,则该复盐中含有Al3+,b.有刺激性气味气体放出,说明该复盐中含有NH4+,则该复盐为:NH4Al(SO4)2,
①NH4Al(SO4)2在溶液中的电离方程式是NH4Al(SO4)2═Al3++NH4++2SO42-;
②氢氧根离子先与铝离子反应生成氢氧化铝沉淀,然后氢氧根离子和铵根离子反应生成一水合氨,最后氢氧根离子和氢氧化铝反应生成偏铝酸根离子和水,以此判断实验现象的顺序.
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝,则C是氨气;
①A、B两种离子在加热条件下可生成C、D两种分子,A是10电子的阳离子,能生成氨气,则A是铵根离子,B是氢氧根离子,D是水;
③1molB离子与1molE离子作用可生成2mol D分子,则E是水合氢离子;
④向含F离子的溶液中加入氨气的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解则F是铝离子,沉淀W是氢氧化铝.
(1)通过以上分析知,A的化学式为:NH4+,E是水合氢离子,F是铝离子,在周期表中位于第三周期第IIIA族;
(2)铝离子和氨水反应生成氢氧化铝和铵根离子,离子反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
氢氧化铝和氢氧根离子反应生成偏铝酸根离子和水,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O;
(3)a.溶液中出现白色沉淀,c.沉淀逐渐增多,e.沉淀逐渐减少,d.沉淀完全消失,说明此沉淀为Al(OH)3,则该复盐中含有Al3+,b.有刺激性气味气体放出,说明该复盐中含有NH4+,则该复盐为:NH4Al(SO4)2,
①NH4Al(SO4)2在溶液中的电离方程式是NH4Al(SO4)2═Al3++NH4++2SO42-;
②氢氧根离子先与铝离子反应生成氢氧化铝沉淀,然后氢氧根离子和铵根离子反应生成一水合氨,最后氢氧根离子和氢氧化铝反应生成偏铝酸根离子和水,以此判断实验现象的顺序.
解答:
解:由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子.已知A、E是由非金属元素组成的阳离子,
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝,则C是氨气;
①A、B两种离子在加热条件下可生成C、D两种分子,A是10电子的阳离子,能生成氨气,则A是铵根离子,B是氢氧根离子,D是水;
③1molB离子与1molE离子作用可生成2mol D分子,则E是水合氢离子;
④向含F离子的溶液中加入氨气的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解则F是铝离子,沉淀W是氢氧化铝.
(1)通过以上分析知,A的化学式为:NH4+,E是水合氢离子,F是铝离子,在周期表中位于第三周期第IIIA族,
故答案为:NH4+;水合氢离子;第三周期、ⅢA族;
(2)铝离子和氨水反应生成氢氧化铝和铵根离子,离子反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
氢氧化铝和氢氧根离子反应生成偏铝酸根离子和水,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-═AlO2-+2H2O;
(3)a.溶液中出现白色沉淀,c.沉淀逐渐增多,e.沉淀逐渐减少,d.沉淀完全消失,说明此沉淀为Al(OH)3,则该复盐中含有Al3+,b.有刺激性气味气体放出,说明该复盐中含有NH4+,则该复盐为:NH4Al(SO4)2,
①NH4Al(SO4)2在溶液中的电离方程式是NH4Al(SO4)2═Al3++NH4++2SO42-,
故答案为:NH4Al(SO4)2═Al3++NH4++2SO42-;
②氢氧根离子先与铝离子反应生成氢氧化铝沉淀,然后氢氧根离子和铵根离子反应生成一水合氨,最后氢氧根离子和氢氧化铝反应生成偏铝酸根离子和水,因此实验现象的顺序为acbed,
故答案为:acbed.
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝,则C是氨气;
①A、B两种离子在加热条件下可生成C、D两种分子,A是10电子的阳离子,能生成氨气,则A是铵根离子,B是氢氧根离子,D是水;
③1molB离子与1molE离子作用可生成2mol D分子,则E是水合氢离子;
④向含F离子的溶液中加入氨气的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解则F是铝离子,沉淀W是氢氧化铝.
(1)通过以上分析知,A的化学式为:NH4+,E是水合氢离子,F是铝离子,在周期表中位于第三周期第IIIA族,
故答案为:NH4+;水合氢离子;第三周期、ⅢA族;
(2)铝离子和氨水反应生成氢氧化铝和铵根离子,离子反应方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
氢氧化铝和氢氧根离子反应生成偏铝酸根离子和水,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;Al(OH)3+OH-═AlO2-+2H2O;
(3)a.溶液中出现白色沉淀,c.沉淀逐渐增多,e.沉淀逐渐减少,d.沉淀完全消失,说明此沉淀为Al(OH)3,则该复盐中含有Al3+,b.有刺激性气味气体放出,说明该复盐中含有NH4+,则该复盐为:NH4Al(SO4)2,
①NH4Al(SO4)2在溶液中的电离方程式是NH4Al(SO4)2═Al3++NH4++2SO42-,
故答案为:NH4Al(SO4)2═Al3++NH4++2SO42-;
②氢氧根离子先与铝离子反应生成氢氧化铝沉淀,然后氢氧根离子和铵根离子反应生成一水合氨,最后氢氧根离子和氢氧化铝反应生成偏铝酸根离子和水,因此实验现象的顺序为acbed,
故答案为:acbed.
点评:本题考查了离子或分子的推断,明确10电子原子或分子、离子有哪些是解本题关键,难度较大,注意铝离子、铵根离子、氢氧化铝和氢氧根离子反应的先后顺序.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
用分液漏斗不可以进行分离的混合物是( )
| A、四氯化碳和水 | B、苯和水 |
| C、花生油和水 | D、酒精和水 |
在500℃和催化剂存在的条件下,在固定容积的容器中发生如下反应2SO2(g)+O2(g)
2SO3(g)(正反应放热).下列有关说法正确的是( )
| 催化剂 |
| 500℃ |
| A、若降低温度,可以加快反应速率 |
| B、在上述条件下,SO2能完全转化为SO3 |
| C、使用催化剂是为了加快反应速率 |
| D、达到平衡时,SO2和SO3的浓度一定相等 |
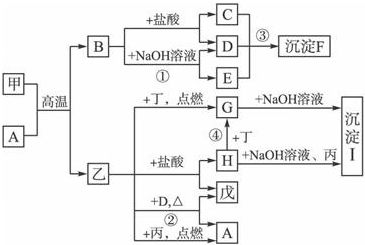 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物. 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示: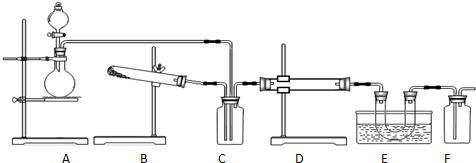
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.