题目内容
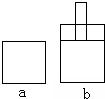 如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.
如图所示两个极易导热的密闭容器a和b,容器a体积恒定,容器b体积可变,在起始温度、体积相等的条件下,按下列两种情况投料.Ⅰ、向a和b中充入等物质的量的NO2,发生反应:2NO2?N2O4;△H<0;
Ⅱ、向a和b中充入等物质的量的N2O4,发生反应:N2O4?2NO2;△H>0.
以下判断对Ⅰ、Ⅱ两种情况均正确的是( )
| A、反应起始时,两容器内反应速率va和vb的关系为:va=vb |
| B、反应过程中,两容器内反应速率va和vb的关系为:va<vb |
| C、反应达平衡时,两容器内反应物的转化率αa和αb的关系为:αa<αb |
| D、反应达平衡时,两容器内压强Pa和Pb的关系为:Pa>Pb |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、反应起始时,反应物的浓度相同、温度相同、压强相同,反应速率相同;
B、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变,压强越大,反应速率越快;
Ⅱ、容器a体积不变,随反应进行,反应混合气体的物质的量增多,容器a中压强增大,容器b体积可变,压强不变,压强越大,反应速率越快;
C、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变压强不变,容器b中压强大于容器a中,压强增大平衡正向移动;
Ⅱ、容器a体积不变,随反应进行,反应混合气体的物质的量增多,容器a中压强升高,容器b体积可变压强不变,容器b中压强小于容器a中,压强增大平衡逆向移动;
D、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变.
B、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变,压强越大,反应速率越快;
Ⅱ、容器a体积不变,随反应进行,反应混合气体的物质的量增多,容器a中压强增大,容器b体积可变,压强不变,压强越大,反应速率越快;
C、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变压强不变,容器b中压强大于容器a中,压强增大平衡正向移动;
Ⅱ、容器a体积不变,随反应进行,反应混合气体的物质的量增多,容器a中压强升高,容器b体积可变压强不变,容器b中压强小于容器a中,压强增大平衡逆向移动;
D、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变.
解答:
解:A、反应起始时,反应物的浓度相同、温度相同、压强相同,反应速率相同,故A正确;
B、Ⅰ、容器a中压强降低,容器b压强不变,压强越大,反应速率越快,故v(a)<v(b),而Ⅱ、容器a中压强增大,容器b压强不变,压强越大,反应速率越快,故v(a)>v(b),故B错误;
C、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变,容器b中压强大于容器a中,压强增大平衡正向移动,转化率αa和αb的关系为:αa<αb;Ⅱ、容器a体积不变,随反应进行,反应混合气体的物质的量增多,容器a中压强升高,容器b体积可变压强不变,容器b中压强小于容器a中,压强增大平衡逆向移动,转化率αa和αb的关系为:αa<αb,故C正确;
D、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(a)<p(b),故D错误;
故选AC.
B、Ⅰ、容器a中压强降低,容器b压强不变,压强越大,反应速率越快,故v(a)<v(b),而Ⅱ、容器a中压强增大,容器b压强不变,压强越大,反应速率越快,故v(a)>v(b),故B错误;
C、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变,容器b中压强大于容器a中,压强增大平衡正向移动,转化率αa和αb的关系为:αa<αb;Ⅱ、容器a体积不变,随反应进行,反应混合气体的物质的量增多,容器a中压强升高,容器b体积可变压强不变,容器b中压强小于容器a中,压强增大平衡逆向移动,转化率αa和αb的关系为:αa<αb,故C正确;
D、Ⅰ、容器a体积不变,随反应进行,反应混合气体的物质的量减小,容器a中压强降低,容器b体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(a)<p(b),故D错误;
故选AC.
点评:本题考查影响化学反应速率的有关因素,题目难度较大,难在Ⅰ与Ⅱ的对比上,注意题目实际为恒温条件.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
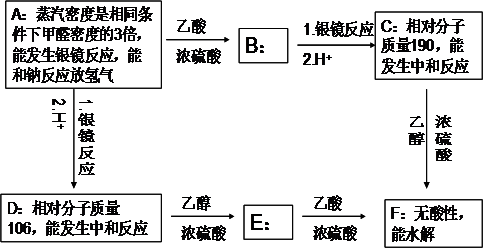
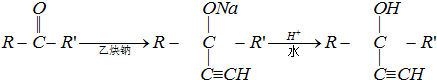
 (碳碳双键)在一定条件下与氧化剂作用,如:
(碳碳双键)在一定条件下与氧化剂作用,如:

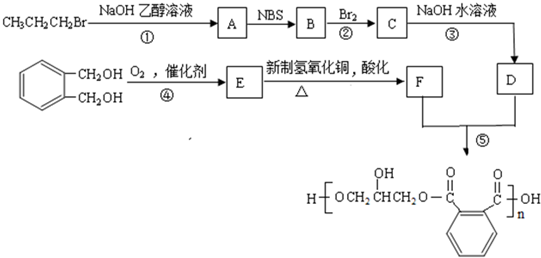
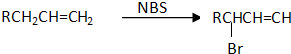
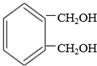 互为同分异构体的结构简式
互为同分异构体的结构简式
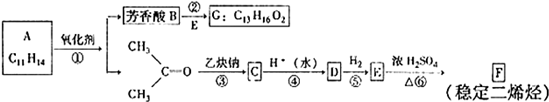
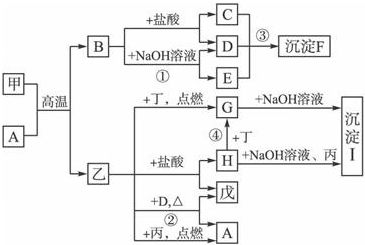 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物. 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示: