题目内容
8.关于金属腐蚀和防护原理的叙述中,错误的是( )| A. | 埋在地下的钢管与电源负极连接可以减缓腐蚀 | |
| B. | 原电池负极和电解池阳极发生的都是氧化反应 | |
| C. | 钢铁析氢腐蚀的正极反应:2H++2e→H2↑ | |
| D. | 为了避免青铜器生成铜绿,将青铜器放在银质托盘上 |
分析 A.被保护的金属连接电源负极;
B.在原电池负极和电解池阳极上都发生失电子的反应
C.钢铁发生析氢腐蚀时,正极上氢离子放电;
D.金属铜比金属银活泼,原电池中负极金属比正极金属更易腐蚀.
解答 解:A.埋在地下的钢管与电源负极连接可以减缓腐蚀,故A正确;
B.在原电池负极和电解池阳极上都发生失电子的氧化反应,故B正确;
C.钢铁发生析氢腐蚀时,负极铁失电子,正极上氢离子得电子,则正极的反应为:2H++2e-═H2↑,故C正确;
D.将青铜器放在银质托盘上会形成原电池,金属铜为负极,负极金属比正极金属银更易腐蚀,铜易变为铜绿,故D错误;
故选D.
点评 本题考查学生金属的腐蚀和防护知识,注意原电池的正极金属和电解池的阴极金属难以被腐蚀,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列铁的化合物可以分别通过化合反应、置换反应、复分解反应生成的是( )
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
19.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢气体溶于水 | B. | 碘升华 | ||
| C. | 加热氯酸钾使其分解 | D. | 氯化钠溶于水 |
16.下列说法正确的是( )
| A. | 乙烯和聚乙烯都能使溴水褪色 | |
| B. | 用新制的氢氧化铜浊液不能检验淀粉和纤维素是否发生了水解 | |
| C. | 油脂的水解反应,都是皂化反应 | |
| D. | 橄榄油、茶籽油和花生油等都能使溴水褪色 |
3.下列有关表述正确的是( )
| A. | N原子的价电子轨道表示式: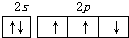 | |
| B. | 碳酸氢钠在水溶液中的电离方程式:NaHCO3?Na++H++CO32- | |
| C. | 羧基的结构式: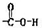 | |
| D. | 明矾的化学式为 KAlSO4•12H2O |
20.某蓝色手柄滴定管滴定后读数如图所示,则以下记录的数据正确的是( )
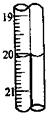

| A. | 20.00mL | B. | 20.0mL | C. | 20.10mL | D. | 20.1mL |
17.用密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀完全为止.已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为( )
| A. | 21.9% | B. | 43.1% | C. | 13.5mol/L | D. | 5.67mol/L |