题目内容
17.用密度为1.32g/cm3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀完全为止.已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为( )| A. | 21.9% | B. | 43.1% | C. | 13.5mol/L | D. | 5.67mol/L |
分析 硫酸溶液与BaCl2溶液液发生反应:BaCl2+H2SO4═BaSO4↓+2HCl,已知所生成的溶液的质量等于原BaCl2溶液的质量,则生成沉淀BaSO4的质量等于原硫酸溶液的质量,假设硫酸钡的质量为233g,根据方程式计算的H2SO4质量,进而计算硫酸溶液中硫酸的质量分数;然后根据c=$\frac{1000ρω}{M}$计算出该硫酸的物质的量浓度.
解答 解:假设硫酸钡的质量为233g,由BaCl2+H2SO4═BaSO4↓+2HCl可知,H2SO4质量为98g,由于所生成的溶液的质量等于原BaCl2溶液的质量,则生成沉淀BaSO4的质量等于原硫酸溶液的质量,所以原硫酸溶液的质量为233g,故硫酸溶液中溶质的质量分数=$\frac{98g}{233g}$×100%=42.1%,故A、B错误;
该硫酸溶液的物质的量浓度为:c=$\frac{1000×1.32×42.1%}{98}$mol/L=5.67mol/L,故C错误、D正确;
故选D.
点评 本题考查溶液质量分数计算、物质的量浓度的计算,难度不大,明确“硫酸溶液的质量=硫酸钡的质量”为解答关键,注意掌握物质的量浓度、溶质质量分数的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
7.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 常温常压下,11.2L甲烷含有共价键数为2NA |
8.关于金属腐蚀和防护原理的叙述中,错误的是( )
| A. | 埋在地下的钢管与电源负极连接可以减缓腐蚀 | |
| B. | 原电池负极和电解池阳极发生的都是氧化反应 | |
| C. | 钢铁析氢腐蚀的正极反应:2H++2e→H2↑ | |
| D. | 为了避免青铜器生成铜绿,将青铜器放在银质托盘上 |
5.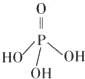 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.
I.用磷矿石在高温下制备白磷(P4)的化学方程式为:2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)
(1)反应中破坏的化学键有abc.
a.离子键 b.极性共价键 c.非极性共价键
(2)白磷肯定不具有的性质是c(单项选择).
a.与强碱发生自身氧化还原反应 b.易溶于CS2
c.点燃时和氢气化合生成PH3 d.易自燃
(3)P4分子呈正四面体结构,分子中有6个P-P键,键角为600.
Ⅱ.磷酸分子结构式见图.三聚磷酸可视为三个磷酸分子之间脱去两个水分子产物,其结构式为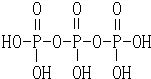 .
.
(5)根据上表数据,写出在溶液中少量H3PO4和NaF反应的离子方程式H3PO4+F-=H2PO4-+HF.
(6)NH3比PH3更易液化,原因可能是c(单项选择).
a.H-N键键能大于H-P键键能
b.NH3分子间范德华力大于PH3分子间范德华力
c.其它原因.
 磷元素的单质及其化合物在生产和生活中有着广泛的应用.
磷元素的单质及其化合物在生产和生活中有着广泛的应用.I.用磷矿石在高温下制备白磷(P4)的化学方程式为:2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)
(1)反应中破坏的化学键有abc.
a.离子键 b.极性共价键 c.非极性共价键
(2)白磷肯定不具有的性质是c(单项选择).
a.与强碱发生自身氧化还原反应 b.易溶于CS2
c.点燃时和氢气化合生成PH3 d.易自燃
(3)P4分子呈正四面体结构,分子中有6个P-P键,键角为600.
Ⅱ.磷酸分子结构式见图.三聚磷酸可视为三个磷酸分子之间脱去两个水分子产物,其结构式为
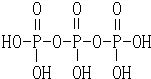 .
.| 电离常数(25℃) |
| HF:Ki=3.6×10 -4 |
| H3PO4:Ki1=7.5×10 -3, Ki2=6.2×10 -8,Ki3=2.2×10 -13 |
(6)NH3比PH3更易液化,原因可能是c(单项选择).
a.H-N键键能大于H-P键键能
b.NH3分子间范德华力大于PH3分子间范德华力
c.其它原因.
12.工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2FeO4+Na2O,下列说法正确的是( )
| A. | 反应中Fe2O3是还原剂 | |
| B. | Fe2O3可以通过铁丝在氧气中燃烧制得 | |
| C. | 3molNa2O2反应,有3mol电子转移 | |
| D. | 在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
2.反应 H2(g)+C12(g)→2HCl(g)的能量变化可用如图表示.下列说法错误的是( )
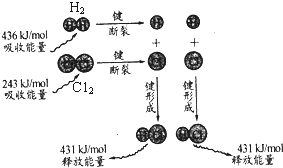

| A. | 2 mol 气态氢原子的能量低于1 mol 氢气 | |
| B. | 氢气分子中的化学键比氯气分子中的化学键更稳定 | |
| C. | 氢气与氯气反应的热化学方程式为H2(g)+C12(g)→2HCl(g)+183 kJ | |
| D. | 该反应在光照和点燃条件下的反应热效应是相同的 |
6.下列叙述正确的是( )
| A. | 油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| B. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| C. | 一定条件下,氨基酸之间能发生反应,合成更复杂的化合物(多肽) | |
| D. | 向2ml苯中加入1ml酸性高锰酸钾溶液,振荡后静置,可观察到液体分层,上层呈紫红色 |
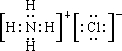 .
.