题目内容
18.下列铁的化合物可以分别通过化合反应、置换反应、复分解反应生成的是( )| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
分析 只有氯化亚铁可分别通过化合反应、置换反应、复分解反应生成,Fe与氯化铁化合生成氯化亚铁铁,氢氧化亚铁与盐酸反应生成氯化亚铁,Fe与盐酸发生置换反应生成氯化亚铁,以此来解答.
解答 解:A.FeCl2可以由FeCl3和Fe的化合得到,也可以由Fe和HCl的置换得到,也可以由Fe(OH)2和HCl的复分解得到,故A选;
B.Fe3O4能通过铁与氧气的化合反应得到,也能通过铁与水蒸气在高温条件下的置换反应得到,但无法通过复分解得到,故B不选;
C.Fe(OH)3可以通过Fe(OH)2和氧气、水的化合得到,也可以通过氯化铁与氢氧化钠的复分解得到,但无法通过置换得到,故C不选;
D.硫酸铁可以通过FeSO4溶液与氧气的化合得到,但无法通过置换得到,故D不选.
故选A.
点评 本题考查铁的化学性质,为高频考点,把握物质的性质、发生的反应、反应类型为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
15.下列实验装置和操作正确的是( )
| A. |  测定C2H6O结构式 | B. |  验证SO2有氧化性 | ||
| C. |  实验室制氨气 | D. |  碘的CCl4溶液中分离I2 |
9.下列离子在强酸性溶液中能大量共存的一项是( )
| A. | Na+、K+、OH-、CH3COO- | B. | Na+、Ba2+、CO32-、NO3- | ||
| C. | Na+、NH4+、Cl-、HCO 3- | D. | Fe3+、K+、SO42-、NO3- |
6.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿按一定比例混合加热可制得铜2Cu2S+Cu2O$\frac{\underline{\;\;△\;\;}}{\;}$6Cu+SO2↑.对于该反应,下列说法中正确的是( )
| A. | 该反应中的氧化剂是Cu2O | |
| B. | 氧化产物和还原产物的物质的量之比为1:6 | |
| C. | Cu既是氧化产物又是还原产物 | |
| D. | Cu2S在反应中仅做氧化剂 |
3.用如图所示装置,必要时可加热试管,不能达到实验目的是( )
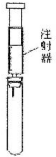

| A. | 试管中盛酚酞试液,验证氨气的水溶液呈碱性 | |
| B. | 试管中盛酸性高锰酸钾溶液,探究乙烯的还原性 | |
| C. | 试管中盛稀氢氧化钠溶液,验证CO2与NaOH反应的产物 | |
| D. | 试管中盛氢硫酸,验证SO2的氧化性 |
10.化学与生活密切相关,下列对应关系错误的是( )
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | 刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 作杀菌消毒剂 |
| D | 二氧化硫具有漂白性 | 漂白纸浆 |
| A. | A | B. | B | C. | C | D. | D |
7.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| C. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA | |
| D. | 常温常压下,11.2L甲烷含有共价键数为2NA |
8.关于金属腐蚀和防护原理的叙述中,错误的是( )
| A. | 埋在地下的钢管与电源负极连接可以减缓腐蚀 | |
| B. | 原电池负极和电解池阳极发生的都是氧化反应 | |
| C. | 钢铁析氢腐蚀的正极反应:2H++2e→H2↑ | |
| D. | 为了避免青铜器生成铜绿,将青铜器放在银质托盘上 |