题目内容
3.下列有关表述正确的是( )| A. | N原子的价电子轨道表示式: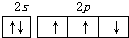 | |
| B. | 碳酸氢钠在水溶液中的电离方程式:NaHCO3?Na++H++CO32- | |
| C. | 羧基的结构式: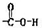 | |
| D. | 明矾的化学式为 KAlSO4•12H2O |
分析 A、洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同;
B、碳酸氢钠是强碱的弱酸盐,电离是强中有弱,电离方程式为:NaHCO3=Na++HCO3-;
C、羧基中两个O原子分别与C原子成键;
D、化合价代数和不为0.
解答 解:A、2p上的3个电子应自旋相同,故A错误;
B、碳酸氢钠是强碱的弱酸盐,电离是强中有弱,电离方程式为:NaHCO3=Na++HCO3-,故B错误;
C、羧基中两个O原子分别与C原子成键,其中一个O原子与碳原子形成双键,另一个O原子与C原子形成单键,故电子式为: ,所以结构式:
,所以结构式: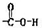 ,故C正确;
,故C正确;
D、根据化合价代数和为0,明矾的化学式为:KAl(SO4)2•12H2O,故D错误;
故选C.
点评 本题考查了轨道式、电离方程式、结构式、化学式的书写,题目难度中等,注意掌握常见化学用语的概念及表示方法.

练习册系列答案
相关题目
18.下列微粒在溶液中能大量共存的是( )
| A. | NH4+、Mg2+、SO42-、CH3COO- | B. | HCO3-、K+、Cl-、AlO2- | ||
| C. | Cu2+、Na+、SO42-、HS- | D. | Na+、H+、SO42-、S2O32- |
8.关于金属腐蚀和防护原理的叙述中,错误的是( )
| A. | 埋在地下的钢管与电源负极连接可以减缓腐蚀 | |
| B. | 原电池负极和电解池阳极发生的都是氧化反应 | |
| C. | 钢铁析氢腐蚀的正极反应:2H++2e→H2↑ | |
| D. | 为了避免青铜器生成铜绿,将青铜器放在银质托盘上 |
12.工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2FeO4+Na2O,下列说法正确的是( )
| A. | 反应中Fe2O3是还原剂 | |
| B. | Fe2O3可以通过铁丝在氧气中燃烧制得 | |
| C. | 3molNa2O2反应,有3mol电子转移 | |
| D. | 在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
13.在一定温度和压强下,2L气体XY2与1L气体Y2化合,生成2L气体化合物,则该化合物的化学式为( )
| A. | X3Y | B. | X3Y2 | C. | X2Y3 | D. | XY3 |
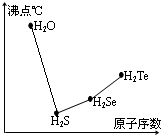 氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.
氧族元素的单质及其化合物对人类的生活、生产有着举足轻重的影响.如氧气、水、臭氧、二氧化硫等.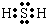 .在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.
.在H2S分子中,两个H-S键之间的夹角小于(填“大于”、“小于”或“等于”)180°,H2S分子属极性极性此空不填(填“极[来源:]性”或“非极性”)分子.