题目内容
5.“来自石油和煤的两种基本化工原料”A和甲.A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯.其合成路线如图所示.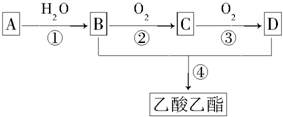
(1)A分子的电子式是
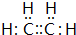 ;C的分子式是C2H4O.
;C的分子式是C2H4O.(2)在反应①~④中,属于加成反应的是①(填序号).
(3)写出反应④的化学方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.写出反应②的化学方程式:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O.
(4)可用于鉴别B、D和甲的一种试剂是饱和Na2CO3溶液.
分析 B连续发生氧化反应生成D,二者反应得到乙酸乙酯,则B为CH3CH2OH,D为CH3COOH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应生成乙酸,A是气态烃,与水反应生成乙醇,A和甲是“来自石油和煤的两种基本化工原料”,则A为CH2=CH2,甲为苯,以此解答该题.
解答 解:B连续发生氧化反应生成D,二者反应得到乙酸乙酯,则B为CH3CH2OH,D为CH3COOH,乙醇发生催化氧化生成C为CH3CHO,乙醛进一步发生氧化反应生成乙酸,A是气态烃,与水反应生成乙醇,A和甲是“来自石油和煤的两种基本化工原料”,则A为CH2=CH2,甲为苯,
(1)由上述分析可知,A为CH2=CH2,电子式为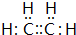 ,C为乙醛,分子式为C2H4O,故答案为:
,C为乙醛,分子式为C2H4O,故答案为: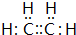 ;C2H4O;
;C2H4O;
(2)反应①是乙烯与水发生加成反应生成乙醇,反应②是乙醇发生氧化反应生成乙醛,反应③是乙醛发生氧化反应生成乙酸,反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,也属于取代反应,故答案为:①;
(3)反应④的化学反应方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,B→C是乙醇氧化生成乙醛,反应方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(4)由于乙酸具有酸性,乙醇溶于水,而苯与水溶液不互溶,可以碳酸钠溶液鉴别B(乙醇)、D(乙酸)和甲(苯),故答案为:饱和Na2CO3溶液.
点评 本题考查有机物的推断,为高频考点,侧重学生的分析能力的考查,涉及烯烃、醇、醛、羧酸的性质与转化,题目难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
16. 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
 某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).实验记录如下:
| 实验操作 | 实验现象 | |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色. |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化. |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色. |
(1)A中反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
(2)实验操作Ⅱ吹入热空气的目的是吹出单质Br2.
(3)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式H2O2+2Br-+2H+=Br2+2H2O.
(4)由上述实验得出的结论是氧化性:H2O2>Br2>H2SO3.
13.第101号元素钔最稳定的一种原子可以表示为${\;}_{101}^{258}Md$,该原子所含中子的数目为( )
| A. | 56 | B. | 157 | C. | 258 | D. | 101 |
10.扁桃酸(Mandelic Acid)是一种医药中间体,用于合成环扁桃酸酯等,其结构简式为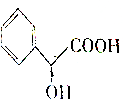 下列说法正确的是( )
下列说法正确的是( )
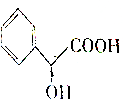 下列说法正确的是( )
下列说法正确的是( )| A. | 扁桃酸分子至多有10个原子在同一平面 | |
| B. | 扁桃酸在一定条件下能发生消去反应 | |
| C. | 某酯与扁桃酸互为同分异构体,苯环上有2个取代基且能与氯化铁发生显色反应,该酯的结构有3种 | |
| D. | 由苯乙烯(C6H5CH=CH2)合成扁桃酸需经过加成→水解→氧化→还原等步骤 |
17.某常见有机物(分子内碳原子总数不超过10个)的结构简式可表示为 ,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
 ,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )
,其核磁共振氢谱图中出现两组峰,且不同化学环境的氢原子数之比为3:2.下列关于该有机物的说法错误的是( )| A. | 该有机物燃烧时一定只生成CO2和H2O | |
| B. | 该有机物不可能为芳香醇 | |
| C. | 该有机物的分子式可能为C8H10O2 | |
| D. | 该有机物可能与NaOH溶液反应 |
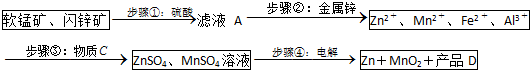
11.MnO2和锌是制造干电池的主要原料.电解法生产MnO2传统的工艺主要流程为:软锰矿加煤还原焙烧;用硫酸浸出焙烧料;浸出液(主要含Mn2+)经净化后再进行电解,MnO2在电解池的阳极析出.90年代后期发明了生产MnO2和锌的新工艺,主要是采用软锰矿(主要成分为MnO2,含少量Al2O3和SiO2杂质)和闪锌矿(主要成分为ZnS,含少量FeS、CuS、CdS杂质)为主要原料,经过除杂后,得到含Zn2+、Mn2+离子的溶液,再通过电解同时获得MnO2和锌.简化流程框图如图(中间产物的固体部分已经略去):
已知各种金属离子完全沉淀的pH如表:
回答下列问题:
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是溶解软锰矿、闪锌矿,可以循环利用.

已知各种金属离子完全沉淀的pH如表:
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中,软锰矿、闪锌矿粉与硫酸溶液共热时析出硫的反应为氧化还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S↓+2H2O,请写出MnO2在酸性溶液中分别和CuS和FeS发生反应的化学方程式:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S↓+2H2O、MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S↓+6H2O.
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成份为Cu、Cd(用化学符号表示)
(3)步骤③物质C由多种物质组成,其中含有两种固体,其中一种为MnO2,其作用是将Fe2+氧化为Fe3+,另外一种固体物质可为Zn(OH)2.
(4)步骤④中电解过程中MnO2在阳极析出,该电极上发生的反应方程式为Mn2+-2e-+2H2O=MnO2+4H+.产品D的化学式为H2SO4,该物质对整个生产的意义是溶解软锰矿、闪锌矿,可以循环利用.