题目内容
5. 苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为: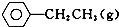 ?催化剂
?催化剂 ═CH2(g)+H2(g)
═CH2(g)+H2(g)(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为25%;
②乙苯的平衡转化率为33.3%;
③计算此温度下该反应的平衡常数$\frac{a}{6V}$.
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率>30%(填“>、=、<”).
(3)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | 612 | 436 |
分析 (1)用三行式求出平衡时各组分的物质的量,氢气的物质的量分数等于氢气物质的量除以气体总物质的量,转化率等于消耗量除以起始量,仍然根据三行式求出平衡时各组分的浓度,最后代入平衡常数表达式;
(2)根据平衡移动原理,若反应体系中加入稀释剂,向计量数增加的方向移动;
(3)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差.
解答 解:(1)设乙苯的变化量为x,
C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)
起始量 a mol 0 0
变化量 x mol x mol x mol
平衡量 (a-x)mol x mol x mol
由题可知:$\frac{x}{a-x+2x}$×100%=25%,则x=$\frac{1}{3}$a,
即:a-x=2x,
①因为平衡体系中苯乙烯的物质的量分数为25%,则氢气的物质的量分数为25%,乙苯的物质的量分数为50%,
故答案为:25%;
②乙苯的平衡转化率为 $\frac{xmol}{amol}$×100%=33%,故答案为:33.3%;
③x=$\frac{1}{3}$a,平衡状态下乙苯平衡浓度为$\frac{a-x}{V}$=$\frac{2a}{3V}$,结合化学平衡三行计算列式计算平衡浓度,
C6 H5-CH2 CH3 (g)?C6 H5-CH=CH2 (g)+H2(g)
起始浓度/( mol•L-1):$\frac{a}{V}$ 0 0
变化浓度/( mol•L-1):$\frac{a}{3V}$ $\frac{a}{3V}$ $\frac{a}{3V}$
平衡浓度/( mol•L-1):$\frac{2a}{3V}$ $\frac{a}{3V}$ $\frac{a}{3V}$
K=$\frac{\frac{a}{3V}×\frac{a}{3V}}{\frac{2a}{3V}}$=$\frac{a}{6V}$,
故答案为:$\frac{a}{6V}$;
(2)在相同温度下,若反应体系中加入稀释剂,根据平衡移动原理,向计量数增加的方向移动,即正向移动,转化率增加,故答案为:>;
(3)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,
故答案为:+124.
点评 本题考盖斯定律的应用,化学平衡常数、转化率的计算,注意利用键能计算反应焓变的方法,题目难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案①N2(g)+O2(g)?2NO(g)的平衡常数K=3.84×10-31;
②2SO2(g)+O2(g)?2SO3(g)的平衡常数K=3.10×1025.
则在该温度下,两个化学反应的反应程度之间的关系为( )
| A. | ①>② | B. | ①<② | C. | ①=② | D. | 不能确定 |
| A. | 若t℃时,0.05mol•L-1的Ba(OH)2溶液pH=11,t=25℃ | |
| B. | 常温下,向pH=a的醋酸溶液中加入等体积等浓度的硫酸后,pH=a+1 | |
| C. | 常温下,若c1mol•L-1的氨水与c2mol•L-1的盐酸等体积混合pH=7,则c1>c2 | |
| D. | 等体积等pH的CH3COOH溶液、盐酸分别与足量铝粉反应,盐酸生成H2的量更多 |
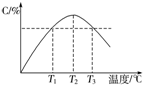
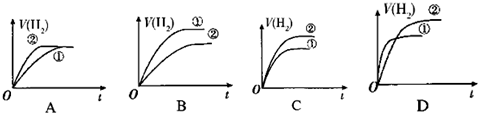
| A. | 0~5 min,C物质的平均反应速率为0.04 mol•L-1•min-1 | |
| B. | 图中温度T1时的正反应速率等于温度T3时的正反应速率 | |
| C. | 该反应温度T2时的平衡常数大于温度T3时的平衡常数 | |
| D. | 图中T2时,若只增大压强,则正、逆反应速率不改变 |
| A. | 利用电泳现象区别溶液和胶体 | |
| B. | 用渗析的方法除去胶体中的离子或分子,以净化胶体 | |
| C. | 用滤纸过滤除去溶液中的胶体粒子 | |
| D. | 向新制Fe(OH)3胶体中加入足量AgNO3溶液,以除去胶体中的Cl- |
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | 这种硫酸在常温下不能使铁钝化 | |
| D. | 配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL |
| A. | 原电池是把电能转变为化学能的装置 | |
| B. | 原电池中电子流出的一极是负极,发生氧化反应 | |
| C. | 原电池的两极发生的反应均为氧化还原反应 | |
| D. | 形成原电池后,原电池中的阳离子向负极方向移动 |
 已知:25℃时,下列4种溶液.请回答下列问题.
已知:25℃时,下列4种溶液.请回答下列问题.