题目内容
20.下列实验操作中,正确的是( )| A. | 利用电泳现象区别溶液和胶体 | |
| B. | 用渗析的方法除去胶体中的离子或分子,以净化胶体 | |
| C. | 用滤纸过滤除去溶液中的胶体粒子 | |
| D. | 向新制Fe(OH)3胶体中加入足量AgNO3溶液,以除去胶体中的Cl- |
分析 A.有些胶粒不带电;
B.胶粒不能透过半透膜;
C.溶液和胶体都能透过滤纸;
D.胶体遇电解质溶液发生聚沉.
解答 解:A.有些胶粒不带电,不发生电泳,故A错误;
B.胶粒不能透过半透膜,溶液能透过,可净化胶体,故B正确;
C.溶液和胶体都能透过滤纸,无法除去,故C错误;
D.胶体遇电解质溶液发生聚沉,不能除杂,故D错误.
故选B.
点评 本题考查胶体的性质,难度不大,注意基础知识的积累,注意除杂不能引入新的杂质.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
1.下列叙述正确的是( )
| A. | 1mol任何气体的气体摩尔体积都约为22.4L/mol | |
| B. | 常温常压下,11.2LO3中所含氧原子个数等于1.5NA | |
| C. | 标准状况下,1mol CCl4所占的体积约为22.4L | |
| D. | 同温、同压下,相同体积的一氧化碳和二氧化碳的质量比为7:11 |
8.工业从铝土矿(主要成分是Al2O3、SiO2、Fe2O3等)提取纯Al2O3再冶炼铝的过程如图所示,下列有关不正确的是( )


| A. | 灼烧操作在蒸发皿中进行 | |
| B. | 若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料 | |
| C. | 若X为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3 | |
| D. | 图示所发生的反应类型有:分解反应、复分解反应、氧化还原反应 |
15.农药波尔多液是一种广谱的保护性杀菌剂,广泛应用于果树、蔬菜和经济作物.波尔多液不能用铁或铝的容器贮存,是因为铁或铝能跟该农药中的硫酸铜发生化学反应,该反应属无机反应类型中的( )
| A. | 化合反应 | B. | 中和反应 | C. | 氧化还原反应 | D. | 复分解反应 |
5. 苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
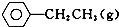 ?催化剂
?催化剂 ═CH2(g)+H2(g)
═CH2(g)+H2(g)
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为25%;
②乙苯的平衡转化率为33.3%;
③计算此温度下该反应的平衡常数$\frac{a}{6V}$.
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率>30%(填“>、=、<”).
(3)已知:
计算上述反应的△H=+124kJ/mol.
 苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为: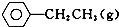 ?催化剂
?催化剂 ═CH2(g)+H2(g)
═CH2(g)+H2(g)(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为25%;
②乙苯的平衡转化率为33.3%;
③计算此温度下该反应的平衡常数$\frac{a}{6V}$.
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率>30%(填“>、=、<”).
(3)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | 612 | 436 |
12.化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
| A. | 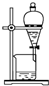 萃取分离 | B. |  转移溶液 | C. | 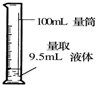 量取液体 | D. | 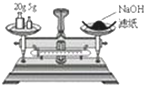 称取NaOH固体 称取NaOH固体 |
9.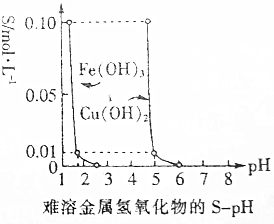 25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
 25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )| A. | pH为5时,可除去CuCl2溶液中的少量Fe3+ | |
| B. | 温度升高时Fe(OH)3溶解速度加快 | |
| C. | 25℃下Ksp[Cu(OH)2]=1.0×10-20 | |
| D. | Fe(OH)3(s)的溶解度随pH增大而减小 |
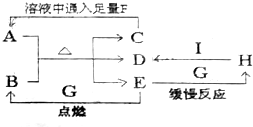 已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1:1混合加热,有如下转化关系:
已知A是治疗胃酸过多症的一种药剂,B是一种淡黄色固体,A、B以物质的量之比1:1混合加热,有如下转化关系: 在通常状况下,A为固态单质.根据下图转化关系,回答:
在通常状况下,A为固态单质.根据下图转化关系,回答: