题目内容
17.浓硫酸和木炭在加热条件下发生反应.如图所示装置可用来检验浓硫酸与木炭在加热条件下反应产生的气体产物.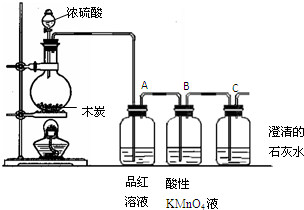
(1)浓硫酸与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)装置B中试剂的作用是除去SO2气体.
(3)能证明装置中存在CO2的现象是产生白色沉淀.
(4)将木炭与浓硫酸共热后得到的适量气体通入下列溶液中,得不到无色澄清溶液的是C(填序号).
A.品红溶液 B.滴加酚酞的氨水 C.Ba(OH)2溶液 D. 溴水.
分析 由实验装置可知,C与浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水,然后利用A中品红溶液检验二氧化硫,B中高锰酸钾溶液除去二氧化硫,C中澄清石灰水检验二氧化碳,以此来解答.
解答 解:由实验装置可知,C与浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水,然后利用A中品红溶液检验二氧化硫,B中高锰酸钾溶液除去二氧化硫,C中澄清石灰水检验二氧化碳,
(1)浓硫酸与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)由上述分析可知,装置B中试剂的作用是除去SO2气体,防止干扰二氧化碳的检验,故答案为:除去SO2气体;
(3)能证明装置中存在CO2的现象是C中产生白色沉淀,故答案为:产生白色沉淀;
(4)木炭与浓硫酸共热后得到的适量气体中含SO2、CO2,
A.二氧化硫能使品红溶液褪色,为无色溶液,故A不选;
B.加酚酞的氨水溶液为红色,氨水与SO2、CO2均反应,碱性减弱,则可得到无色溶液,故B不选;
C.Ba(OH)2溶液均与SO2、CO2反应生成白色沉淀,不能得到无色澄清溶液,故C选;
D.SO2与溴水发生氧化还原反应生成盐酸和硫酸,可得到无色澄清溶液,故D不选;
故答案为:C.
点评 本题考查性质实验方案的设计,为高频考点,把握浓硫酸与木炭反应的产物、气体的检验等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
18.下列反应中,可用离子方程式H++OH-═H2O表示的是( )
| A. | 氢氧化钡和稀硫酸反应 | B. | 氢氧化铜和稀硝酸反应 | ||
| C. | 稀硫酸和氢氧化钾反应 | D. | 氢氧化钠和盐酸反应 |
8.工业从铝土矿(主要成分是Al2O3、SiO2、Fe2O3等)提取纯Al2O3再冶炼铝的过程如图所示,下列有关不正确的是( )


| A. | 灼烧操作在蒸发皿中进行 | |
| B. | 若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料 | |
| C. | 若X为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3 | |
| D. | 图示所发生的反应类型有:分解反应、复分解反应、氧化还原反应 |
5. 苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
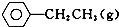 ?催化剂
?催化剂 ═CH2(g)+H2(g)
═CH2(g)+H2(g)
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为25%;
②乙苯的平衡转化率为33.3%;
③计算此温度下该反应的平衡常数$\frac{a}{6V}$.
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率>30%(填“>、=、<”).
(3)已知:
计算上述反应的△H=+124kJ/mol.
 苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为: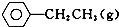 ?催化剂
?催化剂 ═CH2(g)+H2(g)
═CH2(g)+H2(g)(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为25%;
②乙苯的平衡转化率为33.3%;
③计算此温度下该反应的平衡常数$\frac{a}{6V}$.
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率>30%(填“>、=、<”).
(3)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | 612 | 436 |
12.化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
| A. |  萃取分离 | B. |  转移溶液 | C. | 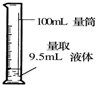 量取液体 | D. | 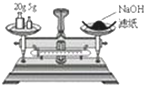 称取NaOH固体 称取NaOH固体 |
2.已知R是短周期元素,存在以下反应:RO3-+6I-+6H+═Rn-+3I2+3H2O.下列叙述正确的是( )
| A. | R是ⅤA族元素 | B. | n=2 | ||
| C. | R 是最外层有7个电子,只能是氯 | D. | Rn-还原性大于 I- |
9.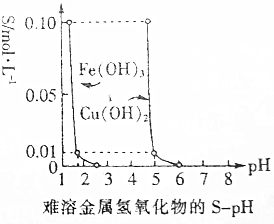 25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
 25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )
25℃时,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示.据图分析,下列判断错误的是( )| A. | pH为5时,可除去CuCl2溶液中的少量Fe3+ | |
| B. | 温度升高时Fe(OH)3溶解速度加快 | |
| C. | 25℃下Ksp[Cu(OH)2]=1.0×10-20 | |
| D. | Fe(OH)3(s)的溶解度随pH增大而减小 |
6.下列溶液中,氯离子浓度最大的是( )
| A. | 100mL 1mol•L-1的NaCl溶液 | B. | 150mL 1mol•L-1的MgCl2溶液 | ||
| C. | 200mL 1mol•L-1的HCl溶液 | D. | 10mL 1mol•L-1的AlCl3溶液 |