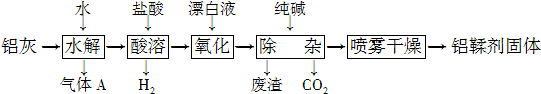
题目内容
10. 已知:25℃时,下列4种溶液.请回答下列问题.
已知:25℃时,下列4种溶液.请回答下列问题.A.0.01mol•L-1氨水 B.0.01mol•L-1 NaOH溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
(1)①4种溶液中,水的电离程度最大的是A(填序号).
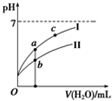
②若将C、D溶液分别稀释10倍,pH变化如图,曲线I对应的溶液为D(填序号).图中a、b、c三点对应溶液的导电能力由强到弱的顺序是b>a>c.(用a、b、c表示)
③若将VmL的D溶液滴入到45mL的B溶液中充分反应后,溶液PH=3,则V=55mL(溶液体积变化忽略不计).
(2)请设计实验证明CH3COOH为弱酸.在常温下,取0.1mol•L-1的CH3COOH溶液,用PH试纸测定,若PH大于1,则说明醋酸为弱酸.
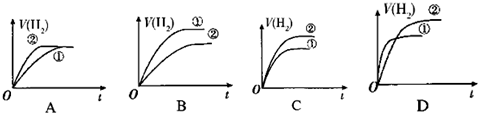
(3)相同体积的C溶液①和D溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是B.(请填序号)
分析 (1)①酸碱都对水的电离起到抑制作用,酸中氢离子、碱中氢氧根离子浓度越小,则水的电离程度越大;
②酸稀释,pH变化大的是强酸,pH变化小的是弱酸;溶液的导电能力和氢离子浓度大小有关;
③根据盐酸和氢氧化钠中和后溶液显示酸性,酸剩余,据此计算溶液的体积大小;
(2)醋酸是弱酸,弱酸不能完全电离,电离出的氢离子浓度要比酸的浓度小;
(3)相同体积的pH=2的醋酸溶液和pH=2盐酸溶液分别与足量的锌粉发生反应,盐酸、醋酸氢离子浓度开始,醋酸的浓度大于盐酸,所以醋酸的物质的量大,据此回答.
解答 解:(1)①酸碱都对水的电离起到抑制作用,酸中氢离子浓度越小、碱中氢氧根离子浓度越小,则水的电离程度越大,0.01mol•L-1氨水中氢氧根离子浓度最小,所以水的电离程度最大;故答案为:A;
②酸稀释,pH变化大的是强酸,pH变化小的是弱酸,若将C、D溶液分别稀释10倍,曲线I对应的溶液为盐酸,溶液的导电能力和氢离子浓度大小有关,浓度越大,导电能力越强,所以a、b、c三点对应溶液的导电能力由强到弱的顺序是b>a>c,
故答案为:D;b>a>c;
③根据盐酸和氢氧化钠中和后溶液显示酸性,酸剩余,溶液的pH=$\frac{0.01V-0.01×45}{V+45}$=0.001,解得V=55mL,故答案为:55mL;
(2)醋酸是弱酸,弱酸不能完全电离,电离出的氢离子浓度要比酸的浓度小,在常温下,取0.1mol•L-1的CH3COOH溶液,用PH试纸测定,若PH大于1,则说明醋酸为弱酸,故答案为:在常温下,取0.1mol•L-1的CH3COOH溶液,用PH试纸测定,若PH大于1,则说明醋酸为弱酸;
(3)相同体积的pH=2的醋酸溶液和pH=2盐酸溶液分别与足量的锌粉发生反应,盐酸、醋酸氢离子浓度开始是一样大,所以开始产生氢气的速率一样,但是醋酸的浓度大于盐酸,所以产生氢气的体积大,随着反应进行,醋酸的电离不断向右移动,氢离子的物质的量增加,所以反应过程醋酸的快,故选B.
点评 本题考查学生弱电解质的电离、溶液pH的计算以及反应速率的影响因素等知识,属于综合知识的考查,难度中等.

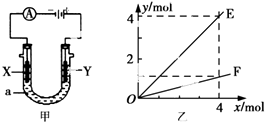
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5 mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极,a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
 苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6 H5-CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5-CH=CH2)的反应方程式为: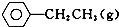 ?催化剂
?催化剂 ═CH2(g)+H2(g)
═CH2(g)+H2(g)(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为25%;
②乙苯的平衡转化率为33.3%;
③计算此温度下该反应的平衡常数$\frac{a}{6V}$.
(2)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率>30%(填“>、=、<”).
(3)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ/mol | 412 | 348 | 612 | 436 |
| A. | R是ⅤA族元素 | B. | n=2 | ||
| C. | R 是最外层有7个电子,只能是氯 | D. | Rn-还原性大于 I- |
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 当有1mol Cl2生成时,有0.5 mol电子发生转移 | |
| C. | 氧化产物是MnCl2,还原产物Cl2 | |
| D. | 相同物质的量的KMnO4和MnO2分别与足量浓盐酸充分反应产生Cl2质量之比为5:2. |
①1-甲基丙烷
②3,4-二甲基戊烷
③2-乙基丁烷
④3-乙基-2-甲基戊烷.
| A. | 只有②③ | B. | 只有③④ | C. | 都正确 | D. | 都错误 |