题目内容
19.用已知物质的量浓度的HCl 滴定未知浓度的NaOH 溶液时,下列操作会导致测定结果偏低的是( )①酸式滴定管用蒸馏水洗后未用标准液润洗;
②取待测碱液时滴定管尖嘴处未充满溶液
③锥形瓶用蒸馏水洗后再用待测液润洗;
④滴定过程中,滴定管活塞处漏出液体;
⑤读取标准溶液体积时,滴定前仰视,滴定后俯视.
| A. | ②④ | B. | ③⑤ | C. | ①④ | D. | ②⑤ |
分析 根据c(NaOH)=$\frac{c(盐酸)V(盐酸)}{V(NaOH)}$及不当操作导致V(盐酸)偏小或V(NaOH)偏大,则导致测定结果偏低,以此来解答.
解答 解:①酸式滴定管用蒸馏水洗后未用标准液润洗,V盐酸偏大,c(NaOH)偏高,故不选;
②取待测碱液时滴定管尖嘴处未充满溶液,n(NaOH)偏小,则消耗的V盐酸偏小,则浓度偏低,故选;
③锥形瓶用蒸馏水洗后再用待测液润洗,消耗V盐酸偏大,则浓度偏高,故不选;
④滴定过程中,滴定管活塞处漏出液体,V盐酸偏大,c(NaOH)偏高,故不选;
⑤读取标准溶液体积时,滴定前仰视,滴定后俯视,消耗的V盐酸偏小,则浓度偏低,故选;
故选D.
点评 本题考查中和滴定,为高频考点,把握酸碱中和滴定的实质、误差分析为解答的关键,侧重分析与应用能力的考查,注意结合公式分析误差,题目难度不大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
7. 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
操作如下:
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
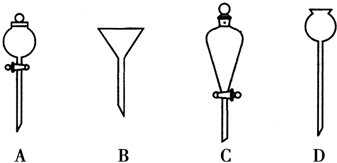
(2)进行分液操作时,使用的漏斗是C(填选项).
(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | 溶解度 /(g/100g水) |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
①在50mL圆底烧瓶中,加入18.5mL正丁醇和13.4mL冰醋酸,3~4滴浓硫酸,投入沸石.安装分水器(作用:实验过程中不断分离除去反应生成的水)及回流冷凝管.
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗,10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥.
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1g乙酸正丁酯.
请回答有关问题:
(1)冷水应该从冷凝管a(填“a”或“b”)端管口通入.
(2)进行分液操作时,使用的漏斗是C(填选项).

(3)仪器A中乙酸和正丁醇制备乙酸正丁酯的化学方程为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
(4)步骤①“不断分离除去反应生成的水”的目的是使用分水器分离出水,使平衡正向移动,提高反应产率.
(5)步骤②中用10% Na2CO3溶液洗涤有机层,该步操作的目的是除去产品中含有的乙酸等杂质.
(6)乙酸正丁酯的产率为65%.
14.在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是( )
| A. | 乙烯→乙二醇:CH2═CH2$\stackrel{加成}{→}$ $\stackrel{取代}{→}$ $\stackrel{取代}{→}$ | |
| B. | 溴乙烷→乙醇:CH3CH2Br$\stackrel{消去}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷→1,3-丁二烯:CH3CH2CH2CH2Br$\stackrel{消去}{→}$CH3CH2CH=CH2$\stackrel{加成}{→}$ $\stackrel{消去}{→}$CH2═CH-CH═CH2 $\stackrel{消去}{→}$CH2═CH-CH═CH2 | |
| D. | 乙烯→乙炔:CH2═CH2$\stackrel{加成}{→}$ $\stackrel{消去}{→}$CH≡CH $\stackrel{消去}{→}$CH≡CH |
11.某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)?3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%.在此平衡体系中加入1molZ(g),恒定温度条件下,在平衡后X、Y、Z的体积分数不变.下列叙述正确的是( )
| A. | 第二次平衡时,Z的浓度为0.2 mol•L-1 | |
| B. | m=3 | |
| C. | X与Y的平衡转化率之比为1:2 | |
| D. | 加入Z后平衡没移动 |
8.下列离子方程式正确的是( )
| A. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O | |
| B. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |