题目内容
9.醋酸的电离方程式是CH3COOH?H++CH3COO-,其电离常数表达式是Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$.分析 醋酸是弱电解质,在溶液中部分电离,电离平衡常数为生成物浓度幂之积与反应物浓度幂之积的商.
解答 解:醋酸是弱电解质,在溶液中部分电离,则电离方程式为CH3COOH?H++CH3COO-,电离平衡常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$;
故答案为:CH3COOH?H++CH3COO-;Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$.
点评 本题考查了电离方程式的书写、电离平衡常数表达式,题目难度不大,注意掌握强电解质与弱电解质的判断方法,能够根据电离方程式的书写原则正确书写常见的电解质的电离方程式.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
20.高铁酸钠是一种新型、高效、多功能水处理剂,高铁酸钠(Na2FeO4)制备方法有:
湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法不正确的是( )
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移4 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
17.下列含氯化合物中,不能由金属单质和氯气直接反应得到的是( )
| A. | FeCl2 | B. | CuCl2 | C. | AlCl3 | D. | AgCl |
4.据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH?CH3CHO;已知△H<0.据此你认为下列说法中正确的是( )
| A. | 该星球表面温度很高 | |
| B. | 该星球表面温度很低 | |
| C. | 低温下稳定性CH2=CHOH>CH3CHO | |
| D. | 该反应中CH2=CHOH化学键断裂吸收能量大于CH3CHO化学键形成放出能量 |
14. 已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
 已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )
已知如表25℃时某些弱酸的电离平衡常数.如图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.依据所给信息,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
| A. | 如图中的两种酸分别和等浓度的NaOH溶液刚好完全反应,消耗碱的体积相等 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | a、b、c三点所示溶液中水的电离程度c>a>b | |
| D. | 图象中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a |
1.电解质溶液的电导率越大,导电能力越强.用0.1mol•L-1的NaOH溶液分别滴定体积均为10.00mL浓度均为0.1mol•L-1的盐酸和CH3COOH溶液,利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )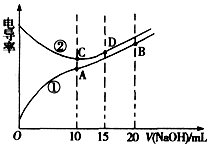

| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05 mol.L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C | |
| D. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) |
18.下列物质用途错误的是( )
| A. | 天然气用于民用燃料 | B. | 纯酒精用作医用消毒 | ||
| C. | 来苏水用于制杀菌剂 | D. | 福尔马林用于浸制生物标本 |
13.某工业废水中含有一定量的Cr2O72-和CrO42-,现取样该工业废水,检测其中铬的含量.
步骤I:取25.00mL废水,加入适量稀硫酸酸化.
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H +═2Cr3++3I2+7H2O然后滴入几滴指示剂.
步骤Ⅲ:用0.1000mol•L-1Na2S2O3溶液滴定(I2+2Na2S2O3═2NaI+Na2S4O6)滴定结果如下:
步骤Ⅳ:将上述反应后溶液进行调节PH,过滤等处理:沉淀回收,滤液倒入下水道.
回答下列问题
(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黄色;
(2)Cr2O72-水解的离子方程式Cr2O72-+H2O?2CrO42-+2H+ 步骤I加入稀硫酸酸化的目的是使CrO42-尽可能的转化成Cr2O72--,为步骤Ⅱ提供酸性环境
(3)在滴定时0.1000mol•L-1Na2S2O3溶液应盛放在碱式滴定管(填仪器名称),步骤Ⅱ中所加指示剂是淀粉溶液.
(4)步骤Ⅲ判断滴定达到终点的现象是溶液由蓝色变为无色,且在半分钟内不变色.
(5)以下操作会造成废水中Cr2O72-含量偏高的是CD.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
(5)步骤Ⅳ在生产生活中的意义是防止重金属污染(任答一条).
步骤I:取25.00mL废水,加入适量稀硫酸酸化.
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H +═2Cr3++3I2+7H2O然后滴入几滴指示剂.
步骤Ⅲ:用0.1000mol•L-1Na2S2O3溶液滴定(I2+2Na2S2O3═2NaI+Na2S4O6)滴定结果如下:
| Na2S2O3起始读数 | Na2S2O3 终点读数 | |
| 第一次 | 0.10mL | 18.30mL |
| 第二次 | 0.30mL | 18.30mL |
回答下列问题
(1)含Cr2O72-的溶液呈橙色,含CrO42-的溶液呈黄色;
(2)Cr2O72-水解的离子方程式Cr2O72-+H2O?2CrO42-+2H+ 步骤I加入稀硫酸酸化的目的是使CrO42-尽可能的转化成Cr2O72--,为步骤Ⅱ提供酸性环境
(3)在滴定时0.1000mol•L-1Na2S2O3溶液应盛放在碱式滴定管(填仪器名称),步骤Ⅱ中所加指示剂是淀粉溶液.
(4)步骤Ⅲ判断滴定达到终点的现象是溶液由蓝色变为无色,且在半分钟内不变色.
(5)以下操作会造成废水中Cr2O72-含量偏高的是CD.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
(5)步骤Ⅳ在生产生活中的意义是防止重金属污染(任答一条).