题目内容
1.常温时,向一定量的硫酸铜溶液中滴加pH=11的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的(Ksp[Cu(OH)2]=2.2×10-20)( )| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
分析 A.根据Ksp[Cu(OH)2]=2.2×10-20计算c(OH-),然后计算pH;
B.根据溶液的电荷守恒判断;
C.pH=11的Na0H溶液浓度小于pH=11的氨水;
D.稀释氨水,促进氨水的电离.
解答 解:A.当溶液中c(Cu 2+)=2.2×10-2mol/L时,由Ksp[Cu(OH)2]=2.2×10-20可知,c(OH-)=1×10-9mol/L,则pH=5,故A错误;
B.溶液中存在2c(Cu 2+)+c(H+)+c(NH4+)=2c(SO4 2-)+c(OH-),当溶液的pH=7时,溶液中2c(Cu 2+)+c(NH4+)=2c(SO4 2-),故B错误;
C.氨水为弱电解质的水溶液,pH=11的Na0H溶液浓度小于pH=11的氨水,若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积大于V,故C错误;
D.稀释氨水,促进氨水的电离,溶液中n(NH4+)增大,n(NH3•H2O)减小,则c(NH4+)/c(NH3•H2O)始终保持增大,故D正确.
故选D.
点评 本题综合考查难溶电解质的溶解以及弱电解质的电离,为高频考点,侧重于学生的分析、计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
16. 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:250ml容量瓶、胶头滴管、药匙.
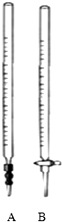
(2)取10.00mL待测液,选择右图中A(填A或B)来移取.
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点.滴定达到终点的标志是:溶液由红色变为无色且半分钟不恢复原色.
(4)根据下列数据,烧碱的纯度为:93.0%(精确到小数点后一位)
(5)判断下列操作引起的误差(填“偏大”、“偏小”或“无影响”)
①滴定前读数正确,滴定终点读数时仰视.偏大.
②未用标准液润洗滴定管.偏大.
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液.偏大.
 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:250ml容量瓶、胶头滴管、药匙.
(2)取10.00mL待测液,选择右图中A(填A或B)来移取.
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶中溶液颜色的变化,直到滴定终点.滴定达到终点的标志是:溶液由红色变为无色且半分钟不恢复原色.
(4)根据下列数据,烧碱的纯度为:93.0%(精确到小数点后一位)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
①滴定前读数正确,滴定终点读数时仰视.偏大.
②未用标准液润洗滴定管.偏大.
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液.偏大.
10.元素R在第五周期,最外层有3个电子,通过画其原子结构示意图可知其原子序数为( )
| A. | 39 | B. | 43 | C. | 49 | D. | 63 |