题目内容
11.2.3g某有机物A完全燃烧后,生成0.1mol CO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,求该化合物的分子式.分析 根据有机物A的蒸气与空气的相对密度是1.6计算A的相对分子质量,根据质量守恒定律判断3g有机物中是否含有O元素,并计算O原子的质量,进而计算C、H、O的物质的量比值,结合相对分子质量可得该有机物的化学式,书写可能的结构简式.
解答 解:n(CO2)=0.1mol,则2.3g有机物中:n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=$\frac{2.7g}{18g/mol}$=0.15mol,则2.3g有机物中:n(H)=2n(H2O)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
因(1.2g+0.3g)<2.3g,所以有机物中还应还用O元素,且m(O)=2.3g-1.2g-0.3g=0.8g,n(O)=$\frac{0.8g}{16g/mol}$=0.05mol,
该化合物的蒸气与空气的相对密度是1.6,则有机物A的相对分子质量=29×1.6=46,有机物A中:n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,所以该有机物的最简式为C2H6O,而C2H6O的相对分子质量为46,所以该有机物的分子式为C2H6O,
答:化合物为C2H6O.
点评 本题考查有机物分子式的确定,难度不大,根据质量守恒判断有机物中是否含有O元素是解答关键.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
1.常温时,向一定量的硫酸铜溶液中滴加pH=11的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的(Ksp[Cu(OH)2]=2.2×10-20)( )
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
19.下列有机物的命名正确的是( )
| A. | 1,2─二甲基戊烷 | B. | 2─乙基戊烷 | C. | 2,3─二甲基戊烷 | D. | 3─甲基己烷 |
16.下列说法中,正确的是( )
| A. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 | |
| B. | 苯的同系物是分子中仅含有一个苯环的所有烃类物质 | |
| C. | 烯烃在适宜的条件下只能发生加成反应不能发生取代反应 | |
| D. | 分子式是C4H8的烃分子中一定含有碳碳双键 |
3.常温下能用铁制容器盛放的是( )
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 硫酸铜 | D. | 稀硫酸 |
20.已知33As、35Br位于同一周期.下列关系正确的是( )
| A. | 原子半径:Br>Cl>P | B. | 热稳定性:AsH3>PH3 | ||
| C. | 碱性:CsOH>Ca(OH)2 | D. | 酸性:H3AsO4>H3PO4 |
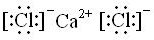 ,属于离子化合物.
,属于离子化合物.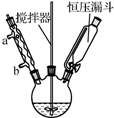 以香豆素3甲酸乙酯(
以香豆素3甲酸乙酯(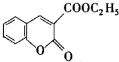 )为原料合成香豆素3甲酸(
)为原料合成香豆素3甲酸(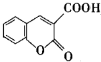 )的装置如图所示,实验步骤如下:
)的装置如图所示,实验步骤如下: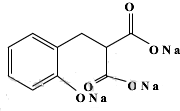 +C2H5OH+H2O.
+C2H5OH+H2O.