题目内容
9.已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.(1)有关上述常数的说法正确的是a.
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显中(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离平衡常数Kb=$\frac{1{0}^{-9}}{a-0.01}$
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为1.0×10-7mol/L,溶液中离子浓度大小关系为c(NH4+)═c(CH3COO-)>c(OH-)═c(H+)
(4)25℃时,H2SO3═HSO3-+H+的电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=0.01mol/L.
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是3.3≤pH<9.(已知lg 2=0.3)
分析 (1)平衡常数只与温度有关,升高温度平衡向吸热方向移动;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH- )═c(H+);根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$;
(3)CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性;水的电离程度很小,据此判断离子浓度大小;
(4)根据亚硫酸第一步电离平衡常数计算亚硫酸浓度;
(5)$\root{3}{\frac{{K}_{sp}[Fe(OH)_{3}]}{0.1}}$≤c(OH- )<$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{0.1}}$.
解答 解:(1)a.平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以它们都能反映一定条件下对应变化进行的程度,故正确;
b.升高温度平衡向吸热方向移动,如果化学平衡正反应是放热反应,则升高温度化学平衡常数减小,故错误;
c.电离平衡常数只与温度有关,温度相同电离平衡常数相同,故错误;
故选a;
(2)所得混合溶液中c(NH4+)=c(Cl-),根据电荷守恒得c(OH- )═c(H+),溶液呈中性;根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(N{{H}_{4}}^{+}).c(O{H}^{-})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{5×1{0}^{-3}×1{0}^{-7}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;$\frac{1{0}^{-9}}{a-0.01}$;
(3)CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液铵根离子和醋酸根离子水解程度相同,导致醋酸铵溶液呈中性,水电离出的氢离子浓度为1.0×10-7mol/L;水的电离程度很小,溶液中离子浓度大小顺序是c(NH4+)═c(CH3COO-)>c(OH- )═c(H+),故答案为:1.0×10-7mol/L;c(NH4+)═c(CH3COO-)>c(OH- )═c(H+);
(4)电离常数Ka=1×10-2mol•L-1,则该温度下pH=3、c(HSO3-)=0.1mol•L-1的NaHSO3溶液中c(H2SO3)=$\frac{c({H}^{+}).c(HS{{O}_{3}}^{-})}{{K}_{a}}$=$\frac{0.001×0.1}{0.01}$mol/L=0.01 mol/L,故答案为:0.01 mol/L;
(5)$\root{3}{\frac{{K}_{sp}[Fe(OH)_{3}]}{0.1}}$≤c(OH- )<$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{0.1}}$,$\root{3}{\frac{8.0×1{0}^{-38}}{0.1}}$mol/L≤c(OH- )<$\sqrt{\frac{1.0×1{0}^{-11}}{0.1}}$mol/L,2×10-13×$\root{3}{100}$mol/L≤c(OH- )<1×10-5mol/L,$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L<c(H+)≤$\frac{1{0}^{-14}}{2×1{0}^{-13}×\root{3}{100}}$mol/L,则3.3≤pH<9,
故答案为:3.3≤pH<9.
点评 本题考查较综合,涉及溶度积常数计算、弱电解质的电离、酸碱混合溶液定性判断等知识点,侧重考查学生分析计算能力,把握化学反应原理及难溶物溶解平衡是解本题关键,注意弱电解质电离平衡常数与其对应弱离子水解程度关系,题目难度中等.

 口算题天天练系列答案
口算题天天练系列答案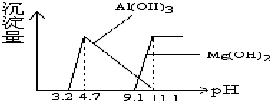 根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:
根据Al(OH)3 的Ksp=1.3×10-33、Mg(OH) 2的Ksp=5.6×10-12,等物质的量浓度AlCl3、MgCl2混合溶液与NaOH溶液反应生成相应沉淀,pH与沉淀量关系如下图:下列有关说法正确的是( )
| A. | Al(OH)3 和Mg(OH)2在水溶液中的电离过程完全相同 | |
| B. | 若改变溶液的pH,在pH<4.7时,n(Mg2+)几乎不变化 | |
| C. | 当pH>11.1时,溶液中只有NaCl和NaAlO2(Na[Al(OH)4]) | |
| D. | 等物质的量浓度Al3+、Mg2+混合溶液与氨水反应生成相应沉淀,氨水的pH与沉淀量关系与上图相似 |
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是CD (填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
滴定数据如表:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为0.2 mol•L-1.
(3)沉淀滴定要求滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D(填选项字母).
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
| A. | HClO | B. | HClO2 | C. | HClO3 | D. | HClO4 |
| A. | 1,2─二甲基戊烷 | B. | 2─乙基戊烷 | C. | 2,3─二甲基戊烷 | D. | 3─甲基己烷 |
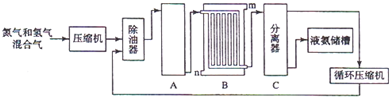
 H2+CO,CH4+H2O
H2+CO,CH4+H2O 3H2+CO;
3H2+CO;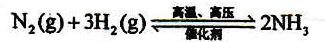 ;
;