题目内容
13.W、X、Y、Z、Q是原子序数依次增大的前四周期元素.W是宇宙中最丰富的元素;X、Z元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含有Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液.回答下列问题:
(l)第一电离能Y大于Z,电负性Y小于Z(均选填“大于”、“小于”或“等于’,).
(2)写出与XZ分子互为等电子体的一种离子的化学式CN-.
(3)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,原因是乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,故有晶体析出;该深蓝色晶体中,中心离子的电子排布式为[Ar]3d9,配体为NH3
(4)已知W、Y形成的一组二元化合物化学式为:YW3、Y2W4、Y3W5、Y4W6…其中,YW3分子中Y原子的杂化类型为sp3杂化;这组化合物的通式为NnHn+2W、Y形成的化合物的种类比W、X形成的化合物的种类少(填“多”或“少”).
(5)Q单质的晶体属于面心立方最密堆积.己知Q单质的密度是dg•cm-3,NA表示阿伏伽德罗常数的值,Q的相对原子质量为M,则Q晶体中最邻近的原子核间距为$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{d{N}_{A}}}$cm(用含M、d、NA的代数式表示).Q原子在晶胞中的空间利用率为$\frac{\sqrt{2}π}{6}$(用含π的代数式表示).
分析 W是宇宙中最丰富的元素,W为H元素;
X、Z元素原子基态时,核外电子均排布在3个能级上,则X、Z为第2周期元素,它们的价电子层上均有两个未成对电子,则X为C元素,Z为O元素;
X为C元素,Z为O元素,W、X、Y、Z、Q是原子序数依次增大的前四周期元素,则Y为N元素;
向含有Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液,则Q为Cu元素.由此解答.
(1)同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构;同周期元素从左到右,元素的电负性逐渐增强;
(2)根据等电子体中原子数相同、价电子数相同分析;
(3)[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出蓝色晶体[Cu(NH3)4]SO4;
(4)根据中心原子电子对数判断杂化方式;H、C形成有机化合物;
(5)根据晶胞边长a=$\root{3}{\frac{m}{ρ}}$计算晶体中最邻近的原子核间距,原子在晶胞中的空间利用率=$\frac{{V}_{球}}{{V}_{晶胞}}×100%$.
解答 解:W是宇宙中最丰富的元素,W为H元素;
X、Z元素原子基态时,核外电子均排布在3个能级上,则X、Z为第2周期元素,它们的价电子层上均有两个未成对电子,则X为C元素,Z为O元素;
X为C元素,Z为O元素,W、X、Y、Z、Q是原子序数依次增大的前四周期元素,则Y为N元素;
向含有Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液,则Q为Cu元素,
由此知W为H,X为C,Y为N,Z为O,Q为Cu,
(1)同周期,随原子序数增大第一电离能增大,但N原子的2p电子半满为稳定结构,则第一电离能N>O,同周期元素从左到右,元素的电负性逐渐增强,则电负性O>N,故答案为:大于;小于;
(2)CO含有2个原子14个电子,所以CO互为等电子体的分子或离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:CN-;
(3)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液,涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,再向深蓝色透明溶液加入乙醇,由于乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以会析出深蓝色的晶体Cu(NH3)4SO4•H2O,形成4个配位键,配体为NH3,中心离子的电子排布式为[Ar]3d9,
故答案为:乙醇极性比水小,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,故有晶体析出;[Ar]3d9;NH3;
(4)NH3分子中N原子电子对数为$\frac{5+1×3}{2}=4$,故杂化方式为sp3杂化,由YW3、Y2W4、Y3W5、Y4W6…分析判断这组化合物的通式为NnHn+2,C、H元素形成烃类有机化合物,数目庞大,故答案为:sp3杂化;NnHn+2;少;
(5)Cu单质的晶体属于面心立方最密堆积,一个晶胞中含有Cu原子数目为$8×\frac{1}{8}+6×\frac{1}{2}=4$,边长a=$\root{3}{\frac{m}{ρ}}$=$\root{3}{\frac{4M}{d{N}_{A}}}$,晶体中最邻近的原子核间距为$\frac{\sqrt{2}}{2}a$=$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{d{N}_{A}}}$,
原子在晶胞中的空间利用率=$\frac{{V}_{球}}{{V}_{晶胞}}×100%$=$\frac{4×\frac{4}{3}π{(\frac{\sqrt{2}}{4}a)}^{3}}{{a}^{3}}$=$\frac{\sqrt{2}π}{6}$.故答案为:$\frac{\sqrt{2}}{2}\root{3}{\frac{4M}{d{N}_{A}}}$;$\frac{\sqrt{2}π}{6}$.
点评 本题综合考查物质的结构和性质,侧重于学生的分析能力的考查,注意把握杂化类型以及价层电子数的判断,难度中等.

| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加CH3COONa固体促进醋酸的电离 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
(1)用标准盐酸滴定未知浓度的NaOH溶液,下列情况会造成测定结果偏高的是CD (填选项字母).
A.滴定终点读数时,俯视滴定管刻度,其他操作正确
B.盛装NaOH溶液的锥形瓶用蒸馏水洗过,未用NaOH溶液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O
滴定数据如表:
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
②该草酸溶液的物质的量浓度为0.2 mol•L-1.
(3)沉淀滴定要求滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
参考表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D(填选项字母).
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
| A. | HClO | B. | HClO2 | C. | HClO3 | D. | HClO4 |
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 硫酸铜 | D. | 稀硫酸 |
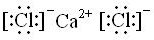 ,属于离子化合物.
,属于离子化合物.