题目内容
6.电解质的水溶液中存在离子平衡.(1)醋酸是常见的弱酸.
①醋酸在水溶液中的电离方程式为CH3COOH?CH3COO-+H+.
②下列方法中,可以使醋酸稀溶液中CH3COOH的电离程度增大的是bc(填字母序号).
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol•L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液的pH随加入NaOH溶液体积而变化的两条滴定曲线.
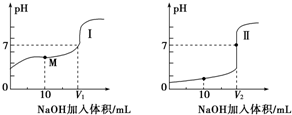
①滴定醋酸溶液的曲线是I(填“Ⅰ”或“Ⅱ”).
②滴定开始前,两种溶液中由水电离出的c(H+)最大的是醋酸.
③V1和V2的关系:V1<V2(填“>”“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
分析 (1)①醋酸是弱电解质,在水溶液中存在电离平衡;
②升高温度、加水稀释或加入和氢离子反应的物质都能使醋酸电离程度增大;
(2)①醋酸是弱电解质,在水溶液中部分电离,HCl是强电解质,在水溶液中完全电离,所以0.1mol/L的醋酸pH>1、0.1mol/L的盐酸pH=1;
②酸抑制水电离,酸中氢离子浓度越大,其抑制水电离程度越大;
③醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使其溶液呈中性,则醋酸应该稍微过量;盐酸是一元强酸,氯化钠是强碱强酸盐,其水溶液呈中性,盐酸和NaOH等浓度混合时,盐酸和氢氧化钠溶液体积相等;
④M点溶液中溶质为等物质的量浓度的醋酸和醋酸钠,溶液pH<0,溶液呈酸性,则(H+)>c(OH-),再结合电荷守恒判断.
解答 解:(1)①醋酸是弱电解质,在水溶液中存在电离平衡,其电离平衡方程式为CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
②a.滴加少量浓盐酸,氢离子浓度增大,抑制醋酸电离,平衡逆向移动,故错误;
b.醋酸电离是吸热反应,升高温度促进醋酸电离平衡正向移动,故正确;
c.加水稀释,促进醋酸电离,平衡正向移动,故正确;
d.加入少量醋酸钠晶体,醋酸根离子浓度增大,平衡逆向移动,故错误;
故选bc;
(2)①醋酸是弱电解质,在水溶液中部分电离,HCl是强电解质,在水溶液中完全电离,所以0.1mol/L的醋酸pH>1、0.1mol/L的盐酸pH=1,根据图知,I是醋酸滴定曲线,故答案为:I;
②酸抑制水电离,酸中氢离子浓度越大,其抑制水电离程度越大,相同浓度的醋酸和盐酸中,醋酸中氢离子浓度小于盐酸,所以盐酸抑制水电离程度大一些,则定开始前,两种溶液中由水电离出的c(H+)最大的是醋酸,故答案为:醋酸;
③醋酸钠是强碱弱酸盐,其水溶液呈碱性,要使其溶液呈中性,则醋酸应该稍微过量;盐酸是一元强酸,氯化钠是强碱强酸盐,其水溶液呈中性,盐酸和NaOH等浓度混合时,盐酸和氢氧化钠溶液体积相等,两种酸用相同浓度的NaOH滴定时,盐酸需要的氢氧化钠体积大一些,即V1<V2,故答案为:<;
④M点溶液中溶质为等物质的量浓度的醋酸和醋酸钠,溶液pH<0,溶液呈酸性,则(H+)>c(OH-),再结合电荷守恒得c(CH3COO-)>c(Na+),所以离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点及其影响因素是解本题关键,侧重考查学生分析及识图能力,题目难度不大.

| A. | 在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大 | |
| B. | 电离平衡常数(K)与温度无关 | |
| C. | 不同浓度的同一弱电解质,其电离平衡常数(K)不同 | |
| D. | 多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
| A. | 滴加过程中,当溶液中c(Cu 2+)=2.2×10-2mol/L时,溶液的pH=9 | |
| B. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO4 2-) | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3•H2O)始终保持增大 |
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 热稳定性H2O>H2Se>H2S |
| A. | HClO | B. | HClO2 | C. | HClO3 | D. | HClO4 |
| 物质 | 杂质 | 除杂试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | Mg | Al | NaOH溶液 | 过滤 |
| C | FeCl2 | FeCl3 | Cu | 过滤 |
| D | NaCl | 泥沙 | 加水 | 溶解、过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 | |
| B. | 苯的同系物是分子中仅含有一个苯环的所有烃类物质 | |
| C. | 烯烃在适宜的条件下只能发生加成反应不能发生取代反应 | |
| D. | 分子式是C4H8的烃分子中一定含有碳碳双键 |
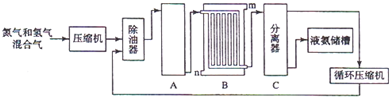
 H2+CO,CH4+H2O
H2+CO,CH4+H2O 3H2+CO;
3H2+CO;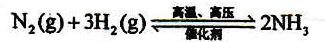 ;
;