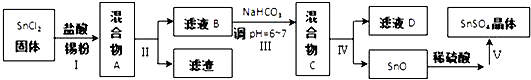
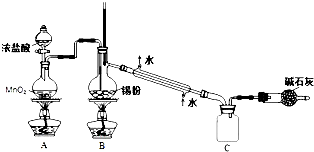
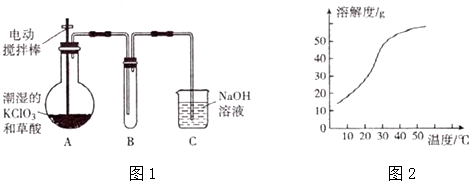
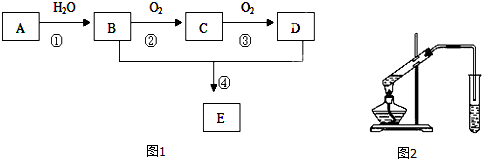
题目内容
20.如图纵坐标为反应物的转化率,横坐标为温度(t℃),下列符合此图情况的反应是( )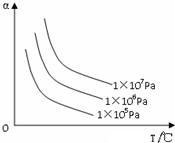
| A. | C(s)+CO2(g)?2CO(g);△H>0 | B. | H2(g)+Br2(g)?2HBr(g);△H<0 | ||
| C. | N2(g)+3H2(g)?2NH3(g);△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g);△H>0 |
分析 由图象可以看出,升高温度,反应物的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应放热;增大压强,反应物的转化率增大,说明增大压强平衡向正反应方向移动,说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,以此解答该题.
解答 解:A.由图象可以看出,升高温度,反应物的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应放热,而C(s)+CO2(g)?2CO(g)△H>0为吸热反应,故A错误;
B.增大压强,反应物的转化率增大,说明增大压强平衡向正反应方向移动,说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,而H2(g)+Br2(g)?2HBr(g)△H<0的前后气体体积相等,故B错误;
C.由图象可以看出,升高温度,反应物的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应放热,增大压强,反应物的转化率增大,说明增大压强平衡向正反应方向移动,说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,反应N2(g)+3H2(g)?2NH3(g)△H<0满足条件,故C正确;
D.升高温度,反应物的转化率降低,说明升高温度平衡向逆反应方向移动,则正反应放热,而2SO3(g)?2SO2(g)+O2(g)△H>0为吸热反应,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,题目难度中等,正确分析图象中反应物的转化率随温度、压强的变化为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
11. 甲苯(
甲苯(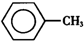 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(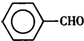 )、苯甲酸(
)、苯甲酸(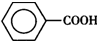 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶.
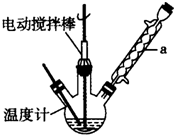
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶
中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过 氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.加入适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.【苯甲酸相对分子质量:122.0】
 甲苯(
甲苯( )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( )、苯甲酸(
)、苯甲酸( )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶
中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过 氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是球形冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为
 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是温度过高时过氧化氢分解速度加快,实际参加反应的过氧化氢质量减小,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温时,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸.
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.加入适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL.产品中苯甲酸的质量分数为87.84%.【苯甲酸相对分子质量:122.0】
5.已知2H2(g)+O2(g)→2H2O(g)+483.6kJ.下列说法或表达正确的是( )
| A. | 在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q1;Q1>241.8kJ | |
| C. | H2(g)+$\frac{1}{2}$O2(g)→H2O(1)+Q2;Q2<241.8kJ | |
| D. | 任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
12.下列表述中正确的是( )
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
9.下列有关元素周期律的叙述中,正确的是( )
| A. | 氧化性强弱:F2<Cl2 | B. | 金属性强弱:Al<Na | ||
| C. | 酸性强弱:H2CO3<HNO3 | D. | 碱性强弱:NaOH<Mg(OH)2 |
10.下列关于物质分类的正确组合是( )
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| A | 氨气 | 硫酸 | 小苏打 | 氧化钙 | 干冰 |
| B | 烧碱 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
| C | 石灰水 | 冰醋酸CH3COOH | 胆矾 CuSO4•5H2O | 过氧化钠 | 二氧化硫 |
| D | NH3•H2O | HNO3 | 碳酸钙 | 氧化铁 | SO3 |
| A. | A | B. | B | C. | C | D. | D |