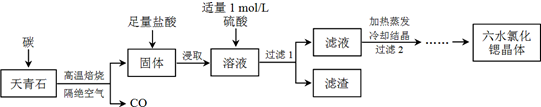
题目内容
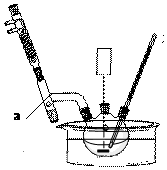
8.ClO2在常温下是一种黄绿色有刺激性气味的气体,熔点:-59℃,沸点:11.0℃,易溶于水.工业上用稍潮湿的KClO3,和草酸(H2C2O4)在60℃时反应制得,某学生拟用图1所示装置模拟工业制取并收集ClO2.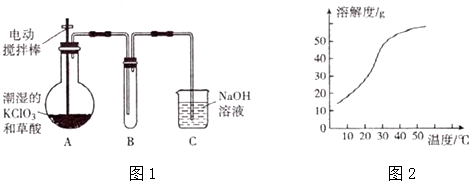
(1)A装罝必须添加温度控制装置,除酒精灯外,还要的玻璃仪器有烧杯、温度计.
(2)B装置必须放在冰水浴中,其原因是使ClO2充分冷凝,减少挥发.
(3)反应后在装置C中可得NaClO2溶液.已知:(1)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,在温度髙于60℃时NaClO2,分解生成NaClO3和NaCl.(2)NaClO2的溶解度曲线如图2所示.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②趁热过滤;③洗涤;④低于60℃干燥;得到成品.
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为5ClO2-+4H+═Cl-+4ClO2↑+2H2O.
(5))用ClO2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是D(填序号).
A.明矾 B.碘化钾 C.盐酸 D.硫酸亚铁
(6)利用ClO2氧化氮氧化物的反应过程如下:
NO$→_{反应Ⅰ}^{ClO_{2}}$NO2$→_{反应Ⅱ}^{Na_{2}SO_{3}水溶液}$无污染气体
反应Ⅰ的化学方程式为2NO+ClO2+H2O═NO2+HNO3+HCl,反应Ⅱ的离子方程式为2NO2+4SO32-═N2+4SO42-.
分析 (1)装置A中稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应生成K2CO3、ClO2和CO2,反应需要可知反应的温度在60°C,需要温度计;
(2)二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行;
(3)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;
(5)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子;
(6)根据流程反应Ⅱ为二氧化氮将亚硫酸钠氧化成硫酸钠,本身被还原成氮气,据此书写离子方程式.
解答 解:(1)反应装置A中的玻璃仪器除酒精灯、烧杯外,还需要可知反应的温度,需要温度计,故答案为:温度计;
(2)二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行,所以应该采用冰水浴,
故答案为:使ClO2充分冷凝,减少挥发;
(3)从NaClO2溶液中制得NaClO2晶体的操作步骤:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品;
故答案为:趁热过滤;低于60℃干燥;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O,
故答案为:5ClO2-+4H+═Cl-+4ClO2↑+2H2O;
(5)若要除去超标的亚氯酸盐,AC均不能还原亚氯酸盐,B中KI具有还原性但氧化产物不适合饮用水使用,只有D中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是D,
故答案为:D;
(6)根据流程反应Ⅱ为二氧化氮将亚硫酸钠氧化成硫酸钠,本身被还原成氮气,离子方程式为:2NO2+4SO32-═N2+4SO42-,故答案为:2NO2+4SO32-═N2+4SO42-.
点评 本题以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,难度中等.

 阶梯计算系列答案
阶梯计算系列答案| A. | BaCl2、Na2CO3、NaOH、盐酸 | B. | NaOH、BaCl2、Na2CO3、盐酸 | ||
| C. | Na2CO3、NaOH、BaCl2、盐酸 | D. | BaCl2、NaOH、Na2CO3、盐酸 |
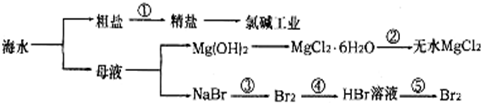
| A. | 过程①需要加入化学试剂、沉淀、过滤等操作 | |
| B. | 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应 | |
| C. | 工业上一般用电解氯化镁溶液制取Mg单质 | |
| D. | 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应 |
| A. | 4个C-H键的长度相等 | B. | 4个C-H键的强度相同 | ||
| C. | 4个C-H键的夹角相同 | D. | 4个C-H连接成正方形 |
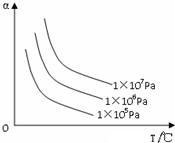
| A. | C(s)+CO2(g)?2CO(g);△H>0 | B. | H2(g)+Br2(g)?2HBr(g);△H<0 | ||
| C. | N2(g)+3H2(g)?2NH3(g);△H<0 | D. | 2SO3(g)?2SO2(g)+O2(g);△H>0 |
| A. | 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于c+d | |
| B. | 若反应开始容器中只有A和B,平衡时,A、B的转化率相等,则A、B的物质的量之比为1:1 | |
| C. | 若平衡体系中共有气体xmol,再向其中充入bmolB,达到平衡时气体总物质的量为(x+b)mol,则a+b=c+d | |
| D. | 若a+b=c+d,升高温度时,A的体积分数不变 |
| A. | 加入足量稀盐酸无沉淀,再加入氯化钡溶液后有白色沉淀产生,一定有SO42- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 某溶液中加入硝酸银溶液生成白色沉淀,说明溶液中有Cl- | |
| D. | 无色溶液中加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
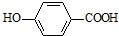 +CH2OH5$\stackrel{催化剂}{→}$
+CH2OH5$\stackrel{催化剂}{→}$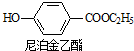 +H2O
+H2O