题目内容
11.某有机化合物A的相对分子质量大于150且小于200.经分析得知,化合物中碳、氢、氧的质量比为7.5:1.125:3.A具有酸性,是蜂王浆中的有效成分,物质的量为0.0002mol的A需用20.0 mL 0.0100mol/L氢氧化钠水溶液来滴定达到滴定终点(1)有机化合物A的相对分子质量(分子量)是186,该化合物的化学式(分子式)C10H18O3,分子中含有碳碳双键和羧基.(2)在一定条件下,烯烃可发生臭氧化还原水解反应,生成羰基化合物,该反应可表示为:
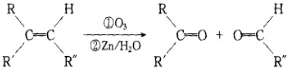
(R R′R″为烃基或氢)
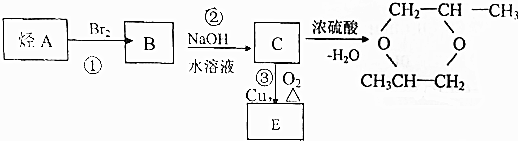
已知有机化合物A能使溴的四氯化碳溶液褪色,A发生臭氧化还原水解反应生成B和C,B能发生银镜反应,且能与金属钠或氢氧化钠溶液反应.
以上反应和B的进一步反应如图所示.
1molD与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况).若将D与F在浓硫酸作用下加热,可以生成一个化学式(分子式)为C4H4O4的六元环G,该反应的化学方程式是HOOCCOOH+HOCH2CH2OH$→_{△}^{浓硫酸}$
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.(3)经测定,有机化合物C没有支链,分子中没有-CH3.写出有机化合物A的结构简式HOOCCH=CH(CH2)6CH2OH.
分析 A具有酸性,物质的量为0.0002mol的A需用20.0 mL 0.0100mol/L氢氧化钠水溶液来滴定达到滴定终点,说明A中有一个羧基,化合物中碳、氢、氧的质量比为7.5:1.125:3,所以氧元素的质量分数为$\frac{3}{7.5+1.125+3}$=0.258,假设分子中有2个氧原子,则相对分子质量为$\frac{32}{0.258}$=124,分子中有3个氧原子,则相对分子质量为$\frac{48}{0.258}$=186,有机化合物A的相对分子质量大于150且小于200,所以分子中含有3个氧原子,符合题意,分子中碳原子数为$\frac{7.5×48}{3×12}$=10,氢原子数为$\frac{1.125×48}{3}$=18,所以A的分子式为C10H18O3,A能使溴的四氯化碳溶液褪色,说明A中有碳碳双键,A发生臭氧化还原水解反应生成B和C,B能发生银镜反应,且能与金属钠或氢氧化钠溶液反应,说明B中有羧基和醛基,B氧化得D,1molD与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况),说明D中有两个羧基,F经两步氧化得D,说明F为醇,D与F在浓硫酸作用下加热,可以生成一个化学式(分子式)为C4H4O4的六元环G,则G应为 ,所以可以推得F为HOCH2CH2OH,E为OHCCHO,D为HOOCCOOH,B为OHCCOOH,有机化合物C没有支链,分子中没有-CH3,结合题中信息可知,C为OHC(CH2)6CH2OH,则A为HOOCCH=CH(CH2)6CH2OH,据此答题.
,所以可以推得F为HOCH2CH2OH,E为OHCCHO,D为HOOCCOOH,B为OHCCOOH,有机化合物C没有支链,分子中没有-CH3,结合题中信息可知,C为OHC(CH2)6CH2OH,则A为HOOCCH=CH(CH2)6CH2OH,据此答题.
解答 解:A具有酸性,物质的量为0.0002mol的A需用20.0 mL 0.0100mol/L氢氧化钠水溶液来滴定达到滴定终点,说明A中有一个羧基,化合物中碳、氢、氧的质量比为7.5:1.125:3,所以氧元素的质量分数为$\frac{3}{7.5+1.125+3}$=0.258,假设分子中有2个氧原子,则相对分子质量为$\frac{32}{0.258}$=124,分子中有3个氧原子,则相对分子质量为$\frac{48}{0.258}$=186,有机化合物A的相对分子质量大于150且小于200,所以分子中含有3个氧原子,符合题意,分子中碳原子数为$\frac{7.5×48}{3×12}$=10,氢原子数为$\frac{1.125×48}{3}$=18,所以A的分子式为C10H18O3,A能使溴的四氯化碳溶液褪色,说明A中有碳碳双键,A发生臭氧化还原水解反应生成B和C,B能发生银镜反应,且能与金属钠或氢氧化钠溶液反应,说明B中有羧基和醛基,B氧化得D,1molD与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况),说明D中有两个羧基,F经两步氧化得D,说明F为醇,D与F在浓硫酸作用下加热,可以生成一个化学式(分子式)为C4H4O4的六元环G,则G应为 ,所以可以推得F为HOCH2CH2OH,E为OHCCHO,D为HOOCCOOH,B为OHCCOOH,有机化合物C没有支链,分子中没有-CH3,结合题中信息可知,C为OHC(CH2)6CH2OH,则A为HOOCCH=CH(CH2)6CH2OH,
,所以可以推得F为HOCH2CH2OH,E为OHCCHO,D为HOOCCOOH,B为OHCCOOH,有机化合物C没有支链,分子中没有-CH3,结合题中信息可知,C为OHC(CH2)6CH2OH,则A为HOOCCH=CH(CH2)6CH2OH,
(1)有机化合物A的相对分子质量(分子量)是186,该化合物的化学式(分子式)为C10H18O3,A的不饱和度=$\frac{10×2+2-18}{2}$=2,羧基的不饱和度是1,所以该分子中含碳碳双键,
故答案为:186;C10H18O3;碳碳双键;
(2)HOOCCOOH与HOCH2CH2OH在浓硫酸作用下发生酯化反应生成 ,反应的方程式为HOOCCOOH+HOCH2CH2OH$→_{△}^{浓硫酸}$
,反应的方程式为HOOCCOOH+HOCH2CH2OH$→_{△}^{浓硫酸}$ +2H2O,HOOCCOOH与碳酸氢钠反应的化学方程式为HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O,
+2H2O,HOOCCOOH与碳酸氢钠反应的化学方程式为HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O,
故答案为:HOOCCOOH+HOCH2CH2OH$→_{△}^{浓硫酸}$ +2H2O;酯化反应;HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O;
+2H2O;酯化反应;HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O;
(3)根据上面的分析可知,C为HOOCCH=CH(CH2)6CH2OH,故答案为:HOOCCH=CH(CH2)6CH2OH.
点评 本题考查有机物推断,侧重考查学生分析判断能力,正确判断A结构简式是解本题关键,结合反应条件、某些物质性质来分析判断,题目难度中等.

| A. | 食盐、糖和醋都可做食品防腐剂 | |
| B. | 青蒿素可以用于治疗疟疾 | |
| C. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
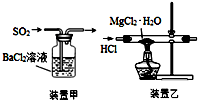
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.440g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,三次结果如下:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
(1)滴定时,KMnO4标准溶液应该装在酸式(填酸式或碱式)滴定管中.
(2)在整个实验过程中,不需要的仪器或用品是④⑥(填序号).
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是加入最后一滴KMnO4溶液,溶液变为浅紫红色,且30s内不褪色.
(4)根据上述数据计算X=3.
(5)若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值偏高(填:偏高、偏低、无影响).
(6)若KMnO4标准溶液浓度偏低,则X值偏低(填:偏高、偏低、无影响).
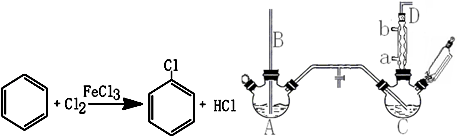
已知:氯苯为无色液体,沸点132.2℃.
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是平衡气压.冷凝管中冷水应从a(填“a”或“b”)处通入.
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯.
①对C加热的方法是c(填序号)
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、苯蒸汽和氯气.
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏.碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本.写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl和HCl+NaOH=NaCl+H2O(写两个即可).
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是五氧化二磷或氯化钙.
(5)工业生产中苯的流失情况如下:
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
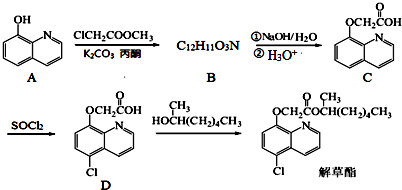
 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.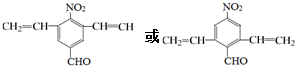 .
.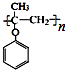 )的合成路线流程(无机试剂可任选).合成路线流程图示例如下:
)的合成路线流程(无机试剂可任选).合成路线流程图示例如下: