题目内容
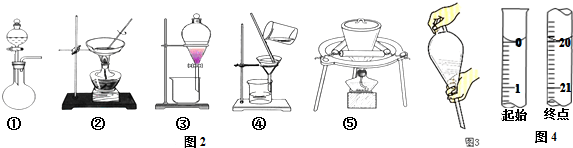
19.下列实验操作不正确的是( )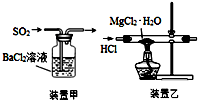
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 将2.5gCuSO4•5H2O溶于水配成100.0mL溶液,得到0.1mol•L-1硫酸铜溶液 | |
| C. | 用装置甲吸收SO2 | |
| D. | 用装置乙制取无水MgCl2 |
分析 A.用稀盐酸洗净铂丝并灼烧至火焰为无色,可排除干扰;
B.溶液体积应为100mL,在烧杯中加水溶解,水的体积应小于100mL;
C.二氧化硫与氯化钡不反应;
D.镁离子水解,应抑制其水解得到无水盐.
解答 解:A.用稀盐酸洗净铂丝并灼烧至火焰为无色,可排除干扰,操作合理,故A正确;
B.溶液体积应为100mL,在烧杯中加水溶解,水的体积应小于100mL,然后冷却、转移到100mL容量瓶中定容,故B正确;
C.二氧化硫与氯化钡不反应,无法除杂,故C错误;
D.镁离子水解,应抑制其水解得到无水盐,所以利用MgCl2•H2O制得无水氯化镁,应采取的措施是在HCl气流中脱水,抑制氯化镁水解,故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验装置的作用、实验技能为解答关键为解答该题的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.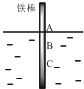 如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )
如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )
 如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )
如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重.下列关于此现象的说法错误的是( )| A. | 该腐蚀过程属于电化腐蚀 | |
| B. | 铁棒AB段电极反应为O2+2H2O+4e→4OH- | |
| C. | 铁棒AB段是负极,BC段是正极 | |
| D. | 产生此现象的根本原因是铁棒所处化学环境的不同 |
7.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓氨水加到盛有AgCl固体的试管中 | AgCl固体完全溶解 | 所得溶液中c(Ag+)•c(Cl-) ≤Ksp(AgCl) |
| B | 向FeI2溶液中通入少量的氯气,再向反应后的溶液中滴加KSCN溶液 | 溶液变为红色 | Cl2能将Fe2+氧化成Fe3+ |
| C | 向固体纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液 | 溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| D | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
14.化学与材料、能源、环境等密切联系.下列说法不正确的是( )
| A. | 研发光电转换材料,充分利用太阳能 | |
| B. | 包装材料聚氯乙烯属于烃,会造成环境污染 | |
| C. | 用石灰对煤燃烧形成的烟气脱硫,并回收石膏 | |
| D. | 研发高效生物生长调节剂,减少对化肥的使用 |
4.由物质X合成乙烯雌酚Y的一种路线如下:
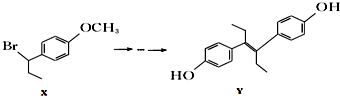
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
18.表是稀硫酸与某金属反应的实验数据:
分析上述数据,回答下列问题:
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
(1)实验4和5表明固体表面积对反应速率有影响;固体表面积越大,反应速率越快,能表明这一规律另一组实验是1和2(填实验序号).
(2)在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有1、3、4(填序号).
(3)本实验中影响反应速率的其他因素还有温度,其实验序号是6和7.
(4)实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:反应物用量相同,放出的热量相同.
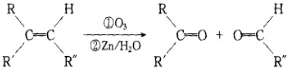
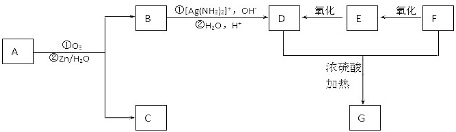
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
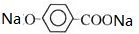 +CO2+H2O→
+CO2+H2O→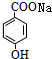 +NaHCO3.
+NaHCO3.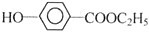
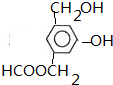 .
.