题目内容
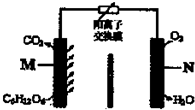 一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )
一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )| A、电池工作时H+从M极区移向N极区 |
| B、N极为正极,发生还原反应 |
| C、M极的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、当N极消耗5.6L(标况下)气体时,则有2NA个H+通过离子交换膜 |
考点:化学电源新型电池
专题:电化学专题
分析:根据题给信息知,该装置是将化学能转化为电能的原电池,由氢离子移动方向知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,外电路中电子从负极沿方向流向正极,据此分析解答.
解答:
解:根据题给信息知,该装置是将化学能转化为电能的原电池,由氢离子移动方向知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,外电路中电子从负极沿方向流向正极,
A.电池工作时H+从负极移向正极,即从M极区移向N极区,故A正确;
B.该装置属于原电池,N为正极,发生还原反应,故B正确;
C.若有机废水中含有葡萄糖,葡萄糖属于燃料,在负极M上失电子发生氧化反应,电极反应式为C6H12O6+6H2O-24e-═6CO2↑+24H+,故C正确;
D、N电极上的反应:O2+4H++4e-=2H2O,当N极消耗5.6L(标况下)即0.25mol氧气时,则有1mol,即NA个H+通过离子交换膜,故D错误.
故选D.
A.电池工作时H+从负极移向正极,即从M极区移向N极区,故A正确;
B.该装置属于原电池,N为正极,发生还原反应,故B正确;
C.若有机废水中含有葡萄糖,葡萄糖属于燃料,在负极M上失电子发生氧化反应,电极反应式为C6H12O6+6H2O-24e-═6CO2↑+24H+,故C正确;
D、N电极上的反应:O2+4H++4e-=2H2O,当N极消耗5.6L(标况下)即0.25mol氧气时,则有1mol,即NA个H+通过离子交换膜,故D错误.
故选D.
点评:本题考查了原电池原理,明确原电池正负极上得失电子、电子流向、电解质溶液中阴阳离子移动方向即可解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定量的10%的NaOH溶液,若将其蒸发掉100g水后,其质量分数为20%,体积为100mL,则浓缩后的NaOH的物质的量浓度为( )
| A、2.2mol/L |
| B、4mol/L |
| C、5mol/L |
| D、6.25mol/L |
核电荷数小于18的某元素X,其原子的电子层数n,最外层电子数为(2n+1),原子核内质子数为(2n2-1).下列关于元素X的说法中,不正确的是( )
| A、其最高化合价为+3价 |
| B、可以形成化学式为KXO3的盐 |
| C、其氢化物可以用来做喷泉实验 |
| D、其最高价氧化物的水化物是强酸 |
下列叙述正确的是( )
| A、1L 0.1mol/L的碳酸钠溶液中C(Na+):C(CO32-)=2:1 |
| B、25℃时NaOH溶液中水的Kw大于100℃时NaCl溶液中水的Kw |
| C、中和体积相同pH相等的硫酸和醋酸溶液,消耗等物质的量浓度的NaOH溶液的体积:硫酸>醋酸 |
| D、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=10-6mol?L-1 |
食品店出售的冰激凌是硬化油,它是以多种植物油为原料而制得的,这时发生的是( )
| A、水解反应 | B、加聚反应 |
| C、加成反应 | D、氧化反应 |
用NA表示阿伏加德罗常数的值.下列说法正确是( )
| A、标准状况下,2.24L二氧化碳中含有共用电子对的数目为0.2NA |
| B、25℃时,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA |
| C、常温常压下,28g乙烯和丙烯的混合气体中含有碳原子的数目为2NA |
| D、0.1mol Cl2与足量铁粉反应转移电子的数目为0.3NA |
下列事故处理方法正确的是( )
| A、凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| B、制取并用排水法收集氧气结束后,应立即停止加热 |
| C、浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| D、浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤 |
