题目内容
下列叙述正确的是( )
| A、1L 0.1mol/L的碳酸钠溶液中C(Na+):C(CO32-)=2:1 |
| B、25℃时NaOH溶液中水的Kw大于100℃时NaCl溶液中水的Kw |
| C、中和体积相同pH相等的硫酸和醋酸溶液,消耗等物质的量浓度的NaOH溶液的体积:硫酸>醋酸 |
| D、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=10-6mol?L-1 |
考点:盐类水解的应用,弱电解质在水溶液中的电离平衡
专题:盐类的水解专题
分析:A、CO32-在溶液中水解浓度减小;
B、温度越高,Kw越大;
C、弱酸中存在电离平衡;
D、NaX溶液中氢离子和氢氧根离子均为水电离的.
B、温度越高,Kw越大;
C、弱酸中存在电离平衡;
D、NaX溶液中氢离子和氢氧根离子均为水电离的.
解答:
解:A、CO32-在溶液中发生水解浓度减小,所以C(Na+):C(CO32-)>2:1,故A错误;
B、温度越高,Kw越大,所以25℃时NaOH溶液中水的Kw小于100℃时NaCl溶液中水的Kw,故B错误;
C、弱酸中存在电离平衡,所以pH相等的硫酸和醋酸溶液,醋酸的浓度远大于硫酸的浓度,二者体积相同时,消耗等物质的量浓度的NaOH溶液的体积:硫酸<醋酸,故C错误;
D、NaX溶液中氢离子和氢氧根离子均为水电离的,所以25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(H+)=10-8mol?L-1,则c(OH-)=10-6mol?L-1,故D正确;
故选D.
B、温度越高,Kw越大,所以25℃时NaOH溶液中水的Kw小于100℃时NaCl溶液中水的Kw,故B错误;
C、弱酸中存在电离平衡,所以pH相等的硫酸和醋酸溶液,醋酸的浓度远大于硫酸的浓度,二者体积相同时,消耗等物质的量浓度的NaOH溶液的体积:硫酸<醋酸,故C错误;
D、NaX溶液中氢离子和氢氧根离子均为水电离的,所以25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(H+)=10-8mol?L-1,则c(OH-)=10-6mol?L-1,故D正确;
故选D.
点评:本题考查了盐的水解原理、Kw的影响因素、弱电解质的电离等,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展.而常温离子液体(ionic liquid)(也称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实.1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃.已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
| A、离子液体可以作为电池的电解质 |
| B、硝酸乙基铵水溶液呈碱性 |
| C、硝酸乙基铵水解的离子方程式表示为:C2H5NH3++H2O═C2H5NH2+H3O+ |
| D、相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小 |
下列微粒中:①12Mg2+ ② ③
③ ④O2-,核外电子总数相同的是( )
④O2-,核外电子总数相同的是( )
 ③
③ ④O2-,核外电子总数相同的是( )
④O2-,核外电子总数相同的是( )| A、②③④ | B、①②④ |
| C、①②③ | D、①③④ |
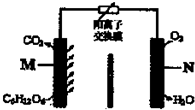 一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )
一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )| A、电池工作时H+从M极区移向N极区 |
| B、N极为正极,发生还原反应 |
| C、M极的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、当N极消耗5.6L(标况下)气体时,则有2NA个H+通过离子交换膜 |
类推是化学学习与研究中常用的方法,下列类推的结论正确的是( )
| A、钠与氧气、水等反应时钠均作还原剂,则金属单质参与反应时金属单质均作还原剂 |
| B、铁能从硫酸铜溶液中置换出铜,则钠也能从硫酸铜溶液中置换出铜 |
| C、碳在少量氧气中燃烧生成CO、在过量氧气中燃烧生成CO2,则硫在少量氧气中燃烧生成SO2、在过量氧气中燃烧生成SO3 |
| D、铝粉在氧气中燃烧生成Al2O3,则铁丝在氧气中燃烧生成Fe2O3 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、一定条件下,2.3g金属钠与氧气完全反应失电子数为0.1NA |
| B、常温常压下,氧气和臭氧(O3)的混合物32g中含有NA个氧原子 |
| C、1molOH- 中含有的电子数为9NA |
| D、0.1mol/L硫酸铝溶液中含有硫酸根的个数为0.3NA |



