题目内容
8.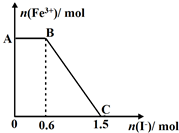 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
分析 氧化性强弱为:K2Cr2O7>Fe3+,由图象可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,BC段为铁离子和碘化钾的反应,结合得失电子守恒解答该题.
解答 解:A.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为$\frac{1.5}{6}$mol=0.25mol,故A错误;
B.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故B正确;
C.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,正确的离子方程式为:2Fe3++2I-=2Fe2++I2,故C错误;
D.由方程式2Fe3++2I-→2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误;
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,注意明确发生的反应及电子守恒计算该题.

练习册系列答案
相关题目
1.在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将容器体积扩大到原来的2倍,当再次达平衡时,W的浓度为原平衡时的0.8倍,下列叙述中正确的是( )
| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率下降 |
19.下列关于食物的酸碱性说法,错误的是( )
| A. | 柠檬吃起来是酸的,故它属于酸性食物 | |
| B. | 正常人体内各体液的pH总保持一定范围 | |
| C. | 通常富含蛋白质、脂肪和糖类的食物多为酸性食物 | |
| D. | 食物的酸碱性与化学上所指溶液的酸碱性是不同的概念 |
16.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为NA | |
| D. | 23g钠在化学反应中得到的电子数为NA |
3.20mL0.02mol•L-1 KMnO4溶液恰好与20mL0.05mol•L-1 Na2SO3溶液完全反应,则Mn在还原产物中的化合价是:(提示:Na2SO3在反应中被氧化成Na2SO4)( )
| A. | 0 | B. | +2 | C. | +3 | D. | +6 |
13.1molRO4-能氧化5mol的Fe2+,则在还原产物中R元素的化合价( )
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
20.有关下列四个常用电化学装置的叙述中,正确的是( )
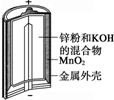 | 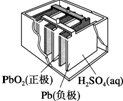 | 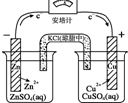 | 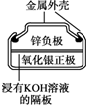 |
| Ⅰ.碱性锌锰电池 | Ⅱ.铅-硫酸蓄电池 | Ⅲ.铜锌原电池 | Ⅳ.银锌纽扣电池 |
| A. | Ⅰ所示电池工作中,MnO2的作用是催化剂 | |
| B. | Ⅱ所示电池放电过程中,硫酸浓度不断增大 | |
| C. | Ⅲ所示电池工作过程中,盐桥中K+移向硫酸锌溶液 | |
| D. | Ⅳ所示电池放电过程中,Ag2O是氧化剂,电池工作过程中还原为Ag |
17.下表是部分短周期元素在周期表中的相对位置关系,试完成以下题目:
(1)表中元素⑤的氯化物的化学式为NCl3,此氯化物的水溶液显酸性.
(2)写出元素⑦在周期表中的位置为第三周期第ⅡA族.
(3)写出元素⑧的单质与NaOH溶液反应的化学方程式2Al+2H2O+2NaOH═2NaAlO2+3H2↑.
(4)某元素的单质在与大气的平流层中能吸收紫外线,被称为地球生物的“保护伞”,则该元素在表中的序号为⑤,该元素的名称为臭氧
(5)元素⑩的单质是一种污染大气的气体,试写出在实验室中吸收该气体的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
| 族 短周期 | ⅠA | ||||||
| ① | |||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||
| ⑦ | ⑧ | ⑨ | ⑩ |
(2)写出元素⑦在周期表中的位置为第三周期第ⅡA族.
(3)写出元素⑧的单质与NaOH溶液反应的化学方程式2Al+2H2O+2NaOH═2NaAlO2+3H2↑.
(4)某元素的单质在与大气的平流层中能吸收紫外线,被称为地球生物的“保护伞”,则该元素在表中的序号为⑤,该元素的名称为臭氧
(5)元素⑩的单质是一种污染大气的气体,试写出在实验室中吸收该气体的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.