题目内容
13.1molRO4-能氧化5mol的Fe2+,则在还原产物中R元素的化合价( )| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
分析 由信息可知,Fe元素的化合价由+2价升高为+3价,R元素的化合价降低,结合电子守恒计算.
解答 解:设还原产物中R元素的化合价为x,
由电子守恒可知,
1mol×(7-x)=5mol×(3-2),
解得x=+2,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与计算能力的考查,注意电子守恒应用,题目难度不大.

练习册系列答案
相关题目
5.下列关于胶体的叙述,不正确的是( )
| A. | 液溶胶都是澄清透明的 | |
| B. | 胶体粒子的直径在1nm~100nm | |
| C. | 可用渗析法(半透膜过滤法)分离液溶胶中的分散质与分散剂 | |
| D. | 可以利用丁达尔效应区分胶体和溶液 |
4.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10 mL量筒量取7.13 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用托盘天平称量25.20 g NaCl | |
| D. | 用25ml碱式滴定管量取21.70 mLNaOH溶液 |
1.向含有2molHNO3的稀溶液中加入3mol铜,充分反应后产生的气体在标准状况下的体积约为( )
| A. | 89.6L | B. | 44.8L | C. | 22.4L | D. | 11.2L |
8.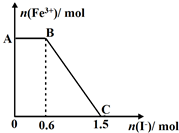 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
18.下列说法中,不能用元素周期律解释的是( )
| A. | 向淀粉KI溶液中滴入溴水,溶液变蓝 | |
| B. | 与冷水反应的速率:Na>Mg | |
| C. | 浓硝酸的氧化性强于稀硝酸 | |
| D. | 原子半径:Al>Si>P |
5.下列各组离子在指定溶液中能大量共存的是( )
| A. | 含大量OH-的溶液:Ba2+、K+、NO3-、AlO2- | |
| B. | 加入Na2O2粉末的溶液:Na+、Cl-、SO32-、OH- | |
| C. | c(KNO3)=1.0mol/L的溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:NH4+、Ba2+、HCO3-、Br- |
 CH2=CH-CH=CH2、=-=.
CH2=CH-CH=CH2、=-=. ,则它的分子式为C9H14O,其官能团为羟基和碳碳双键,它属于脂环化合物(填“芳香化合物”或“脂环化合物”)
,则它的分子式为C9H14O,其官能团为羟基和碳碳双键,它属于脂环化合物(填“芳香化合物”或“脂环化合物”)
 2 图3 图4
2 图3 图4