题目内容
1.在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将容器体积扩大到原来的2倍,当再次达平衡时,W的浓度为原平衡时的0.8倍,下列叙述中正确的是( )| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率下降 |
分析 根据题意知,当恒温下将密闭器的容积扩大一倍的瞬间,如果平衡不移动,W的浓度应是0.5倍,现为原平衡时的0.8倍,说明平衡向正反应方向移动,根据压强对化学平衡的影响分析解答.
解答 解:A、平衡正向移动,故A错误;
B、减小压强向气体体积增大的方向移动,所以a+b<c+d,故B错误;
C、平衡正向移动,则Z的体积分数增加,故C正确;
D、平衡正向移动,则X的转化率增大,故D错误;
故选C.
点评 本题考查了压强对化学平衡的影响,注意增大体积的瞬间,W的体积分数变大来进行判断,否则导致错误判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列物质不会造成水污染的是( )
| A. | O2 | B. | 酸雨 | C. | 石油 | D. | 含磷洗涤剂 |
5.下列关于胶体的叙述,不正确的是( )
| A. | 液溶胶都是澄清透明的 | |
| B. | 胶体粒子的直径在1nm~100nm | |
| C. | 可用渗析法(半透膜过滤法)分离液溶胶中的分散质与分散剂 | |
| D. | 可以利用丁达尔效应区分胶体和溶液 |
7.对于反应4C0(g)+2N02(g)?N2(g)+4C02(g),以下化学反应速率的表示中,所表示反应速率最慢的是( )
| A. | v(CO)=1.6 mol/(L•min) | B. | v(N02)=0.9 mol/(L•min) | ||
| C. | V(N2)=0.25 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
8.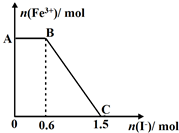 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中正确的是( )| A. | 开始加入的K2Cr2O7为0.45mol | |
| B. | 图中AB段的氧化剂为K2Cr2O7 | |
| C. | 图中BC段发生的反应为Fe3++2I-→Fe2++I2 | |
| D. | K2Cr2O7可与FeSO4反应的物质的量为3:1 |
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.